Agar Lia (Iron Lysina) Co to jest, podkład, przygotowanie, używa
- 3983
- 935
- Eliasz Dubiel
On Agar Lia (Iron Lysina) Jest to test biochemiczny stosowany do identyfikacji bakterii z rodziny Enterobacteriaceae. To medium zostało stworzone przez Edwards i Fife, oparte na formule Falkow.
Pierwotnie ten test był bulion zawierający peptones, ekstrakt drożdżowy, glukozę, l-lizynę, bromocresh i wodę destylowaną fioletową. Edwards i Fife dodali agar-adagar, cytrat żelazowy amonu i tiosulrafatu sodu.
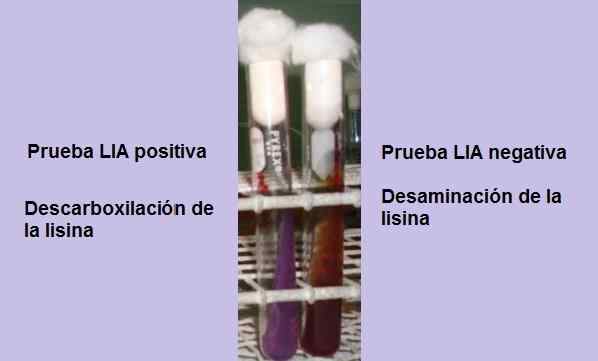
 Pozytywny i negatywny test dekarboksylacji lizyny. Źródło: Zdjęcie i schemat należący do autora MSC. Marielsa Gil
Pozytywny i negatywny test dekarboksylacji lizyny. Źródło: Zdjęcie i schemat należący do autora MSC. Marielsa Gil Test polega zasadniczo na wykazanie obecności enzymu rudboksylazy, zdolnej do reakcji z grupą karboksylową aminokwasu L-Lisin. Deaminacja aminokwasu może również wystąpić z powodu obecności złamanego serca lizyny enzymu.
Dodatkowo skład pożywki pozwala wykazać zdolność niektórych rodzajów bakteryjnych do wytwarzania siarkowodoru. Wreszcie można również obserwować wytwarzanie lub nie gazu na środku.
Podstawa
Peptonas i ekstrakt drożdży
Jak większość mediów uprawnych, agar z żelaza w Lisine zawiera składniki, które zapewniają niezbędne źródło składników odżywczych dla wzrostu bakteryjnego. Te elementy są reprezentowane przez peptones i ekstrakt drożdży.
Glukoza
Podobnie, ten agar zawiera glukozę węglowodanów fermentacyjną. Wiadomo, że wszystkie bakterie rodziny Enterobacteriaceae fermentują glukozę.
Ten krok jest kluczowy, ponieważ będzie odpowiedzialny za zakwaszenie środowiska, niezbędny stan enzymu dekarboksylazy lizyny - jeśli jest obecny - działa na podłoża.
W niektórych gatunkach bakteryjnych produkcję gazu można zaobserwować z powodu fermentacji glukozy.
Gaz jest dowodzony, gdy przemieszczenie agaru.
Może ci służyć: biomateriałyL-lizina
Po dekarboksylowaniu lizyny powstaje diamina (zwłok) i bezwodnik węglowodanów.
Dyskulowanie występuje w obecności koenzymu fosforanu pirydoksalnego. Ta reakcja jest nieodwracalna.
Wskaźnik PH (bromokresol fioletowy)
Wszystkie zmiany pH wystąpiły na środku przez różne reakcje, są wykrywane przez wskaźnik pH bromokresolu.
W tym sensie, gdy występuje zakwaszenie, pożywka staje się żółta, a gdy nastąpi alkalizacja, medium powraca do oryginalnego fioletowego lub fioletowego koloru.
Kiedy odbywa się złamanie serca lizyny z powodu obecności enzymu lizyny, na powierzchni powstaje czerwony kolor, typowy w Proteus, Providence i niektórych gatunkach Morganella.
Wynika to z faktu, że podczas procesu dezaminowania powstaje kwas alfa-zokarboniczny, który reaguje z cytrynianem amonu w obecności tlenu, który powoduje wyżej wspomniany kolor.
Cytrynian żelazowy amonu i tiosulrafatu sodu
Z drugiej strony bakterie wytwarzające siarkowodór będą dowodami2S.
Bakterie, które mają zmniejszony enzym tiosyulfate, mają zdolność działania poprzez zmniejszenie obecnego tiosiarczanu sodu, tworząc siarczan i siarkow wodoru (H (H Hydorowy (H2S).
Ten ostatni jest gazem bezbarwnym, ale podczas reakcji z solą żelaza tworzą siarczk metaliczny, który jest nierozpuszczalnym związkiem (widzialny czarny osad).
Jednak zdolność szkoleniowa H2S z tym medium nie jest bardzo niezawodne, ponieważ niektóre ujemne bakterie dekarboksylazy zdolne do wytwarzania H2S nie tworzy czarnego osadu, ponieważ kwasowość pożywki zakłóca. Dlatego zaleca się potwierdzenie z innymi środkami zawierającymi żelazo.
Może ci służyć: neuronyInterpretacja testu
Rekoksylacja lizyny
Rurki należy odczytać po zakończeniu 24 godzin inkubacji, w przeciwnym razie istnieje ryzyko nieporozumienia, zgłaszania fałszywych negatywów.
Pamiętaj, że pierwszą reakcją, która się nastąpi, będzie fermentacja glukozy, dlatego wszystkie rurki po 10 do 12 godzinach zmienią żółto.
Jeśli pod koniec czasu inkubacji (24 godziny) istnieje żółte tło z fioletową lub fioletową powierzchnią, reakcja jest ujemna. Fioletowy kolor powierzchni odpowiada alkalizacji pożywki za pomocą peptonów.
Pozytywna reakcja polega na tym, że tam, gdzie dno i powierzchnia rurki są całkowicie fioletowe, to znaczy powraca do oryginalnego koloru.
Dlatego, który określa pozytywność testu, jest podstawą lub dnem medium. Jeśli masz wątpliwości co do koloru, można go porównać z nieokreśloną rurką Lia.
Deaminacja lizyny
Rurka, która pokazuje złamane serce lizyny, będzie miała czerwonawą powierzchnię granatową i żółte tło (kwas) lub całą czerwonawą rurkę granatową.
Ta reakcja jest interpretowana jako negatywna dla dekarboksylacji lizyny, ale pozytywna dla deaminacji lizyny.
Ta reakcja jest zdefiniowana i interpretowana w fazie.
Produkcja siarkowodoru (h2S)
Pozytywną reakcję obserwuje się przez pojawienie się czarnego osadu w środku lub jego części. Ogólnie między liml ramki a podstawą.
Jeśli osad nastąpi w całej rurce, nie będzie widać innych reakcji, które występują na środku.
Rejestracja wyników
Podczas interpretacji testu wyniki są rejestrowane w następujący sposób:
Może ci służyć: Miller i Urey ExperimentNajpierw czytana jest ramka, a następnie tło lub taco, a następnie produkcja H2S i wreszcie produkcja gazu.
Przykład: K/A + (-). To znaczy:
- K: Alkaliczna ramka (kolor fioletowy)
- Odp.: Tło kwasowe (żółty), to znaczy ujemna reakcja dekarboksylacji i ujemne złamane serce.
- +: Produkcja siarkowodoru
- (-): bez gazu.
Przygotowanie
Zważyć 35 gr leżących średnich żelaza odwodnionych i rozpuszcza się w litrom wody destylowanej.
Gorąco, aż całkowicie się rozpuści agar, aby zagotować przez minutę, często machając. Rozłóż 4 ml pożywki w rurkach testowych 13/100 z bawełnianą pokrywką.
Sterylizuj w autoklawie w 121 ° C przez 15 minut. Wyjmij z autoklawu i odstawić nachylenie, aby była głęboka baza i krótka faza.
Przechowuj w lodówce 2-8 ° C. Niech temperament przed siewem bakteryjnym.
Kolor odwodnionej pożywki to beżowy i przygotowany czerwonawo fioletowy medium.
Ostateczne pH przygotowanej pożywki wynosi 6,7 ± 0.2
Medium staje się żółte z pH równym lub mniejszym niż 5.2 i jest fioletowe przy pH 6,5 w górę.
Aplikacje
Ten test, wraz z innymi testami biochemicznymi, jest stosowany do identyfikacji Bacilli z rodziny Enterobacteriaceae.
Medium jest wysiewane prostą lub igłą, jedno lub dwa nakłucia są wykonane na dno rurki, a następnie stała powierzchnia medium w zygzakcie.
Jest to inkuba przez 24 godziny w 35-37 ° C w aerobiozie. W razie potrzeby pozostaje inkubacja przez 24 godziny.
Jest to głównie przydatne do różnicowania ujemnych gatunków cytrobacterów od Salmonellas sp.
Bibliografia
- Mac Faddin J. (2003). Testy biochemiczne identyfikacji bakterii znaczenia klinicznego. Wydanie trzecie. Pan -american Editorial. Buenos Aires. Argentyna.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Pan -american Editorial S.DO. Argentyna.

