Struktura adeniny, biosynteza, funkcje
- 3592
- 832
- Prokul Woliński
Adenine Jest to purynowa podstawa azotu, występująca w kwasach rybonukleinowych (RNA) i deoksyrybonukleinie (DNA) żywych organizmów i wirusów. Niektóre z funkcji tych biopolimerów (RNA i DNA) to przechowywanie, replikacja, rekombinacja i transfer informacji genetycznych.
Aby stanowić kwasy nukleinowe, przede wszystkim atomem azotu 9 adeniny tworzy wiązanie glukozydowe z węglem 1 premium (C1 ') rybozy (RNA) lub 2'-desexirribosa (DNA). W ten sposób kształt adenozyny lub nukleozydu adenozyny.
 Źródło: Pepemonbu [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Źródło: Pepemonbu [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] Po drugie, cukier węglowy 5 'oksydrylu (-OH) (ryboza lub 2'-daSaksiribus), adenozyny, tworzy ogniwo estrowe z grupą fosforanową.
W żywych komórkach, w zależności od liczby obecnych grup fosforanowych, może to być adenosín-5'-monofosforan (AMP), adenozyna-5'-difosforan (ADP) i adenosín-5'-trifosforan (ATP). Istnieją również odpowiedniki, które mają 2'-desexirribosa. Na przykład deoksyadenosín-5'-monofosforan (DAMP) itp.
[TOC]
Struktura i cechy
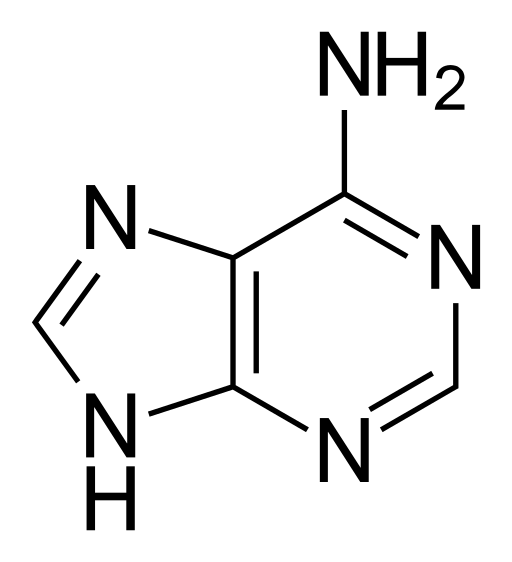
Adenina, zwana 6-aminopuryną, ma wzór empiryczny C5H5N5, I ma masę cząsteczkową 135,13 g/mol, oczyszczając się jako słaby żółty stał, z temperaturą wrzenia 360ºC.
Jego cząsteczka ma podwójną strukturę chemiczną z podwójnymi wiązaniami koniugatu, która jest fuzją pirymidyny z grupą imidazolową. Z tego powodu adenina jest płaską cząsteczką heterocykliczną.
Ma względną rozpuszczalność 0,10 g/ml (przy 25 ° C), w roztworach kwasowych i podstawowych wodnych, z PKA 4,15 (w 25 ° C).
Z tego samego powodu prawdopodobnie zostanie wykryte przez absorbancję przy 263 nm (przy współczynniku E -Absorpcji1,2 mm = 13,2 m-1.cm-1 W HCl 1,0 m) obszar widma elektromagnetycznego odpowiadający bliskiej ultrafioletowej.
Biosynteza
Biosynteza nukleotydów pury jest identyczna u praktycznie wszystkich żywych istot. Zaczyna się od przeniesienia grupy aminowej z glutaminy do podłoża 5-fosforribozylo-1-pirofosforanu (PRPP) i wytwarza 5-fosforribosylaminę (PRA).
Jest to reakcja katalizowana przez transferazę glutaminy-PRPP, kluczowy enzym w regulacji tego szlaku metabolicznego.
Po sekwencyjnych dodaniach aminokwasów glutaminy, glicyny, metanylodatkowatej, asparaginianu, n10-Ref4 Forila-Pra, który obejmuje kondensacje i zamknięcie pierścieni, inozyny-5'-monofosforan (IMP), którego jednostka heterocykliczna jest hipoksantyna (6-oksypurina)), która jest 6-oksypuriną).
Dodatki te są napędzane przez hydrolizę ATP do ADP i fosforanu nieorganicznego (PI). Następnie dodaje się grupę aminową z asparaginianu w reakcji sprzężonej z hydrolizą guanosín-tiffosforanu (GTP), aby w końcu wygenerować AMP.
Ten ostatni sprawuje kontrolę nad tą biosyntetyczną drogą przez negatywne sprzężenie zwrotne, działając na enzymy, które katalizują tworzenie się PRA i modyfikację IMP.
Może ci służyć: czwartorzędni konsumenciPodobnie jak w przypadku degradacji innych nukleotydów, podstawa azotu nukleotydów adenozyny przechodzi proces zwany „recyklingiem”.
Recykling polega na przeniesieniu grupy fosforanowej z PRPP na adeninę oraz formę AMP i pirofosforan (PPI). Jest to pojedynczy etap katalizowany przez adeninę fosforribozylotransferasferazę.
Funkcje w metabolizmie oksydacyjnym i redukcyjnym
Adenina jest częścią kilku ważnych cząsteczek w metabolizmie oksydacyjnym, które są następujące:
- Dyukleotyd Flawiny i Adeniny (FAD/FADH2) i dyukleotyd adeniny nikotynamid+/NADH), które uczestniczą w reakcjach redukcyjnych tlenku poprzez przenoszenie jonów wodorotu (: H-).
- Koenzym A (COA), który uczestniczy w aktywacji i przenoszeniu grup acylowych.
Podczas metabolizmu oksydacyjnego NAD+ Działa jako podłoże akceptora elektronów (jony wodorku) i forma NADH. Podczas gdy moda jest kofaktorem, który akceptuje elektrony i staje się fadh2.
Z drugiej strony, adenina tworzy fosforan dirooticzny nikotynamidu adeniny (NADP+/NADPH), który uczestniczy w metabolizmie redukującym. Na przykład NADPH jest substratem dawcy elektronów podczas biosyntezy lipidowej i deoksyrybonukleotydowej.
Adenina jest częścią witamin. Na przykład niacyna jest prekursorem NAD+ i z NADP+ A ryboflawina jest prekursorem modowym.
Funkcje w ekspresji genów
Adenina jest częścią S-adenosylometiny (SAM), która jest dawcą rodników metylowych (-ch3) i uczestniczy w metylacji odpadów adeniny i cytozyny w prokariotach i eukariotach.
W prokariotach metylacja stanowi system rozpoznawania własnego DNA, który chroni DNA własnych restrykcyjnych enzymów.
U eukariotów metylacja określa ekspresję genów; to znaczy ustala, które geny muszą być wyrażane, a które nie. Ponadto metylacje adeniny mogą oznaczać uszkodzone obszary naprawy DNA.
Wiele białek, które wiążą się z DNA, takimi jak czynniki transkrypcyjne, mają reszty glutaminy i asparaginy, które tworzą wiązania wodorowe z atomem N n7 adeniny.
Funkcje w metabolizmie energii
Adenina jest częścią ATP, która jest cząsteczką o wysokiej energii; Oznacza to, że jego hydroliza jest egzergoniczna, a energia swobodna Gibbs jest wartością wysokiej i ujemnej (-7.0 kcal/mol). W komórkach ATP uczestniczy w wielu reakcjach wymagających energii, takich jak:
- Promuj enderowe reakcje chemiczne przez enzymy, które uczestniczą w metabolizmie i anabolizmie pośrednie.
Może ci służyć: Quintana Roo Flora i Fauna- Promuj biosyntezę białek w rybosomach, umożliwiając estryfikację aminokwasów za pomocą odpowiadającego RNA transferowego (ART), tworząc aminoacil-arnt.
- Promować ruch substancji chemicznych przez błony komórkowe. Istnieją cztery rodzaje białek przenośnych: P, F, V i ABC. Jony transportowe typów P, F i V oraz podłoża typu ABC. Na przykład na atasa+/K+, Klasa P potrzebujesz ATP, aby pompować dwie komórki K w środku+ i trzy na+.
- Napędzać skurcz mięśni. Zapewnia energię ukierunkowaną przez przesuwanie włókien aktyny na miozynę.
- Zwiększ transport nuklearny. Gdy podjednostka beta receptora heterodimerycznego łączy się z ATP, oddziałuje z składnikami kompleksu porów jądrowych.
Inne funkcje
Adenozyna służy jako ligand białek odbiorczych obecnych w neuronach i komórkach nabłonka jelit, gdzie działa jako komunikator pozakomórkowy lub neuromodulator, gdy zachodzą zmiany w metabolizmie energii komórkowej.
Adenina jest obecna w potężnych środkach przeciwwirusowych, takich jak arabiniladenina (ARAA), która jest wytwarzana przez niektóre mikroorganizmy. Ponadto jest obecny w puromicynie, antybiotyku, który hamuje biosyntezę białka i jest wytwarzany przez mikroorganizmy z rodzaju Streptomyces.
W wzmacniaczu służy jako substrat reakcji, który generuje drugie cykliczne posłaniec AMP (AMPC). Ten związek wytwarzany przez enzym cyklazy adenylanowej jest niezbędny w dużej części wewnątrzkomórkowych wodospadów sygnalizacyjnych, niezbędnych do proliferacji i przeżycia komórek, a także w zapaleniu i śmierci komórek.
Siarczan w twoim wolnym stanie nie jest reaktywny. Gdy komórka się wchodzi, staje się adenozyny-5'-fosfosulfate (APS), a następnie w 3'-fosfoadenosín-5'-fosfosulfate (PAPS). U ssaków PAPS jest dawcą grup siarczanowych i tworzy estry siarczanów organicznych, takich jak heparyna i chondroityna.
W biosyntezie cysteiny S-adenosylometina (SAM) służy jako prekursor syntezy S-adenozylohomocysteiny, która jest przekształcana przez kilka etapów, katalizowanych przez enzymy, w cysteinein.
Synteza prebiotyczna
Eksperymentalnie wykazano, że utrzymanie cyjankowodoru (HCN) i amoniaku (NH3), w warunkach laboratoryjnych podobnych do tych, które panują na prymitywnej ziemi, adenina występuje w powstałej mieszaninie. Dzieje się tak bez potrzeby obecności żywej komórki lub materiału komórkowego.
Warunki prebiotyczne obejmują brak swobodnego tlenu cząsteczkowego, wysoce redukującą atmosferę, intensywne promieniowanie ultrafioletowe, duże łuki elektryczne, takie jak te wytwarzane w burzach i wysokie temperatury. Zakłada się, że adenina była główną i najliczniejszą podstawą azotu utworzoną podczas chemii prebiotycznej.
Może ci służyć: flora i fauna z EuropyZatem synteza Adeniny stanowiłby kluczowy krok, który umożliwiłby pochodzenie pierwszych komórek. Musiały mieć błonę, która utworzyła zamkniętą przedział, w której byłyby cząsteczki wymagane do zbudowania pierwszych biologicznych polimerów niezbędnych do samodzielnej perpetacji.
Używam jako komórkowy i terapeutyczny czynnik hodowli
Adenina jest, wraz z innymi organicznymi i nieorganicznymi związkami chemicznymi, niezbędnym składnikiem przepisu stosowanego we wszystkich laboratoriach biochemii, biologii genetycznej, molekularnej i mikrobiologii na świecie, aby uprawiać żywe komórki z czasem.
Wynika to z faktu, że normalne dzikie odmiany komórek mogą wykryć i przechwytywać dostępną adeninę i używać jej do syntezy własnych nukleozydów adeniny.
Oznacza to formę przeżycia komórek, która ekonomizuje zasoby wewnętrzne syntetyzujące bardziej złożone cząsteczki biologiczne z prostych prekursorów pobranych z zagranicy.
W eksperymentalnych modelach przewlekłej choroby nerek myszy mają mutację w genie fosforribozylotransferazy adeniny, który wytwarza enzym nieaktywny. Te myszy są podawane przez zawartość zawartości adeniny, cytrynianu sodu i glukozy, dożylnie, w celu promowania ich szybkiego powrotu do zdrowia.
Leczenie to opiera się na fakcie, że PRPP, początkowy metabolit biosyntezy purynowej, jest syntetyzowany z rybozy-5-fosforanu przez ścieżkę fosforanu pentozowego, którego początkowym metabolitem jest glukozo-6-fosforan. Jednak wiele z tych rozwiązań nie jest zatwierdzonych przez międzynarodowe organy regulacyjne do użytku przez ludzi.
Bibliografia
- Burstock, g. 2014. Puryny i purynoceptory. Przegląd biologii molekularnej. Odniesienia moduły w naukach biomedycznych. Word szeroki adres internetowy: https: // doi.Org/10.1016/B978-0-12-801238-3.04741-3
- Claramount, zm. i in. 2015. Modele zwierzęce chronicznej choroby pediatrycznej. NefrologiaSiemaDo,35 (6): 517-22.
- Coade, s. I Pearson, J. 1989. Metabolizm nukleotydów adeniny. Badania krążenia, 65: 531-37
- Dawson, r. i in. 1986. Dane dotyczące badań biochemicznych. Clarendon Press, Oxford.
- Drougbank. 2019. Adenine Chemichal Arkusz. Word szeroki adres internetowy: https: // www.Bank narkotykowy.CA/leki/DB00173
- Horton, r; Moran, L; Scrimgeour, G; Perry, m. I Rawn, D. 2008. Zasady biochemii. Wydanie 4. Edukacja Pearsona.
- Knight, g. 2009. Odbiorniki puryngiczne. Encyklopedia neuronauki. 1245-52. Word szeroki adres internetowy: https: // doi.Org/10.1016/B978-008045046-9.00693-8
- Mathews, Van Holde, Ahern. 2001. Biochemia. 3. edycja.
- Murgola, e. 2003. Adenine. Encyklopedia genetyki. Word szeroki adres internetowy: https: // doi.Org/10.1006/RWGN.2001.0008
- Murray, R; Granner, D; Mayes, str. I Rodwell, v. 2003. Ilustrowana biochemia Harpera. 26th Wydanie. Firmy McGraw-Hill.
- Nelson, DL & Cox, m. 1994. Lehninger. Zasady biochemii. Wydanie 4. Ed Omega.
- Sigma-Aldrich. 2019. Adenine Arkusz chemiczny. Word szeroki adres internetowy: https: // www.Sigmaaldrich.com/catog/produkt/aldrich/ga8626?Lang = in
- « Charakterystyka i etapy laktogenezy
- Formy pochłaniane ciepłem, jak je obliczyć i rozwiązane ćwiczenia »

