Formy pochłaniane ciepłem, jak je obliczyć i rozwiązane ćwiczenia

- 660
- 50
- Pani Waleria Marek
On wchłonięte ciepło Jest zdefiniowany jako przenoszenie energii między dwoma ciałami w różnych temperaturach. Ten o niższej temperaturze pochłania ciepło niż w wyższej temperaturze. Kiedy tak się dzieje, energia cieplna substancji, która pochłania ciepło, wzrasta, a cząstki, które tworzą go szybciej, podnosząc energię kinetyczną.
Może to przełożyć się na wzrost temperatury lub zmianę stanu. Na przykład przesuń się z stałego do cieczy, na przykład lód, gdy topi się w kontakcie z wodą lub sodą w temperaturze pokojowej.
 Metalowa łyżeczka pochłania gorąca kawa ciepło. Źródło: Pixabay.
Metalowa łyżeczka pochłania gorąca kawa ciepło. Źródło: Pixabay. Dzięki ciepło możliwe jest również, że obiekty zmieniają swoje wymiary. Rozszerzenie termiczne jest dobrym przykładem tego zjawiska. Kiedy większość substancji jest podgrzewana, zwykle doświadczają wzrostu swoich wymiarów.
Wyjątkiem jest woda. Ta sama ilość ciekłej wody zwiększa objętość po schłodzeniu poniżej 4 ºC. Ponadto zmiany temperatury mogą również doświadczyć zmian na poziomie ich gęstości, coś również bardzo obserwowalnego w przypadku wody.
[TOC]
Co jest i formuły
W przypadku energii w tranzycie jednostki pochłonięte ciepłem są dżuli. Jednak przez długi czas upał miał własne jednostki: kalorię.
Nadal dzisiaj jednostka jest używana do ilościowego ilościowego zawartości energii w żywności, chociaż w rzeczywistości kaloria żywności odpowiada kilokalijowi ciepła.
Kalorie
Kaloria, skrócona jako Limonka, Jest to ilość ciepła niezbędnego do podniesienia temperatury 1 grama wody o 1 ° C.
W XIX wieku Sir James Prescott Joule (1818–1889) przeprowadził słynny eksperyment, w którym udało mu się przekształcić pracę mechaniczną w ciepło, uzyskując następującą równoważność:
1 kalorie = 4.186 dżuli
W jednostkach brytyjskich jednostka cieplna nazywa się BTU (Brytyjska jednostka termiczna), który jest zdefiniowany jako ilość ciepła potrzebnego do podniesienia temperatury funta wody w 1 °f.
Może ci służyć: krzywa kalibracji: po co to zrobić, jak to zrobić, przykładyRównoważność między jednostkami jest następująca:
1 BTU = 252 kalorii
Problem z tymi starymi jednostkami polega na tym, że ilość ciepła zależy od temperatury. Oznacza to, że nie jest to samo, co wymaga przejścia od 70 ° C do 75 ° C niż ta wymagana do podgrzania wody z 9 ° C do 10 ° C, na przykład.
Dlatego definicja rozważa dobrze zdefiniowane odstępy: 14.5 do 15.5 ° C i 63 do 64 ° F odpowiednio dla kalorii i BTU.
Co zależy od ilości pochłanianego ciepła?
Ilość pochłanianego ciepła, które zbiera materiał, zależy od kilku czynników:
- Masa. Im wyższa masa, tym więcej ciepła jest w stanie pochłaniać.
- Charakterystyka substancji. Istnieją substancje, które w zależności od ich struktury molekularnej lub atomowej są zdolne do pochłaniania większej ilości ciepła niż inne.
- Temperatura. Wymagane jest dodanie większej ilości ciepła, aby uzyskać wyższą temperaturę.
Ilość ciepła, oznaczona jako Q, Jest proporcjonalny do opisanych czynników. Dlatego możesz napisać jako:
Q = m.C.ΔT
Gdzie M Jest to masa obiektu, C jest stałą nazywaną ciepło właściwe, Wewnętrzna właściwość substancji i δT Jest to zmiana temperatury osiągnięta przez pochłanianie ciepła.
ΔT = tF - Talbo
Ta różnica ma pozytywny znak, ponieważ gdy należy się spodziewać wchłaniania ciepła TF > Talbo. Dzieje się tak, chyba że substancja przeżywa zmianę fazową, taką jak woda, gdy płyn pary mija. Kiedy woda się gotuje, jego temperatura pozostaje stała w około 100 ° C, niezależnie od tego, jak szybko się gotuje.
Jak to obliczyć?
Kontaktując się z dwoma obiektami w innej temperaturze, po pewnym czasie oba osiągają równowagę termiczną. Tak więc temperatury są wyrównane, a transfer ciepła ustaje. To samo dzieje się, jeśli więcej niż dwa obiekty są w kontakcie. Po pewnym czasie wszyscy będą w tej samej temperaturze.
Może ci służyć: magnetyzacja: moment magnetyczny orbital i spin, przykładyZakładając, że obiekty w kontakcie tworzą system zamknięty, z którego ciepło nie może uciec, stosuje się zasadę zachowania energii, aby można było potwierdzić, że:
Q zaabsorbowany = - Q Sceding
Reprezentuje to bilans energetyczny, podobny do galła wejściowych i wydatków osoby. Właśnie dlatego Ceded Heat ma znak ujemny, ponieważ dla obiektu, który daje, końcowa temperatura jest niższa niż początkowa. Dlatego:
ΔT = tF - Talbo < 0
Równanie q zaabsorbowany = - Q Sceding Jest używany, gdy dwa obiekty są w kontakcie.
Bilans energetyczny
Aby wykonać bilans energetyczny, konieczne jest rozróżnienie obiektów, które pochłaniają ciepło od tych, które dają, następnie:
Σ Qk= 0
Oznacza to, że suma zysków energii i straty w zamkniętym systemie musi być równa 0.
Ciepło właściwe substancji
Aby obliczyć ilość pochłanianego ciepła, musisz znać ciepło właściwe każdej uczestniczącej substancji. Jest to ilość ciepła potrzebnego do podniesienia temperatury 1 g materiału o 1 ° C. Jego jednostki w systemie międzynarodowym to: Joule/kg . K.
Istnieją tabele z ciepłem właściwym wielu substancji, ogólnie obliczonych za pomocą kalorymetru lub podobnych narzędzi.
Przykład, jak obliczyć ciepło właściwe materiału
Wymagane jest 250 kalorii w celu podniesienia temperatury metalowego pierścienia od 20 do 30 ° C. Jeśli pierścień ma masę 90 g. Jaki jest ciepło specyficzne w jednostkach SI?
Rozwiązanie
Jednostki są najpierw przekonwertowane:
Q = 250 kalorii = 1046.5 J
M = 90 g = 90 x 10-3 kg
Może ci służyć: wstrząsy elastyczne: w wymiarze, specjalnych przypadkach, ćwiczeniach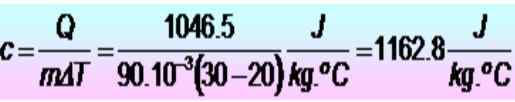
Ćwiczenie rozwiązane
Aluminiowy kubek zawiera 225 g wody i 40 g miedzianych mieszadełek, wszystko w 27 ° C. Próbka 400 g srebra w początkowej temperaturze 87 ° C jest umieszczana w wodzie.
Agitator służy do mieszania mieszaniny, aż osiągnie końcową temperaturę równowagi 32 ° C. Oblicz masę kubka aluminiowego, biorąc pod uwagę, że nie ma strat ciepła w stosunku do środowiska.
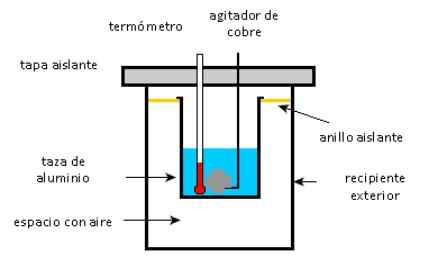 Schemat kalorymetru. Źródło: Solidswiki.
Schemat kalorymetru. Źródło: Solidswiki. Zbliżać się
Jak wspomniano powyżej, ważne jest, aby odróżnić obiekty, które dają ciepło od tych, które pochłaniają:
- Aluminiowy kubek, agitator miedzi i wody pochłaniają ciepło.
- Srebrna próbka daje ciepło.
Dane
Dostarczane są ciepły właściwe każdej substancji:
- Srebro: c = 234 j/kg. ºC
- Miedź: C = 387 J/kg. ºC
- Aluminium C = 900 J/kg. ºC
- Woda C = 4186 J/kg. ºC
Ciepło wchłaniane lub przypisane przez każdą substancję jest obliczane według równania:
Q = m.C.λT
Rozwiązanie
Srebro
Q Sceding = 400 x 10 -3 . 234 X (32 - 87) J = -5148 J
Agitator miedzi
Q zaabsorbowany = 40 x 10 -3 . 387 x (32–7) j = 77.4 J
Woda
Q zaabsorbowany = 225 x 10 -3 . 4186 x (32 - 27) j = 4709.25 J
Aluminiowy kubek
Q zaabsorbowany = m aluminium . 900 x (32 - 27) j = 4500 .M aluminium
Wykorzystanie:
Σ Qk= 0
77.4 + 4709.25 + 4500 .M aluminium = - (-5148)
Wreszcie masa aluminiowa jest oczyszczona:
M aluminium = 0.0803 kg = 80.3 g
Bibliografia
- Giancoli, zm. 2006. Fizyka: zasady z aplikacjami. 6th. Wyd. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fizyka: spojrzenie na świat. 6ta Skrócone wydanie. Cengage Learning. 156 - 164.
- Rex, a. 2011. Podstawy fizyki. osoba. 309 - 332.
- Sears, Zemansky. 2016. Fizyka uniwersytecka z nowoczesną fizyką. 14th. Tom 1. 556 - 553.
- Serway, r., Vulle, c. 2011. Podstawy fizyki. 9na Cengage Learning. 362 - 374
- « Struktura adeniny, biosynteza, funkcje
- Macromolecules Charakterystyka, typy, funkcje i przykłady »

