Charakterystyka aktyny, struktura, włókna, funkcja
- 4822
- 127
- Gabriela Łuczak
Actin Jest to białko cytozolowe, które tworzy mikrofilamenty. W eukariotach aktyna jest jednym z najliczniejszych białek. Na przykład stanowi 10% masy całkowitego białka w komórkach mięśniowych; oraz między 1 a 5% białka w komórkach innych niż.
Białko to, obok pośredników i mikrotubul, tworzy cytoszkielet, którego główną funkcją jest ruchliwość komórki, utrzymanie postaci komórkowej, podział komórek i ruch organelli w roślinach, grzybach i zwierzętach.
 Źródło: Sarcomere.SVG: David Richfield (Użytkownik Slashme) Praca pochodna: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Źródło: Sarcomere.SVG: David Richfield (Użytkownik Slashme) Praca pochodna: Retama [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] Izoformy cytoszkielki aktyny.
Z ewolucyjnego punktu widzenia aktyna jest wysoce zachowanym białkiem. Istnieje około 90% homologii sekwencji u różnych gatunków. W organizmach jednokomórkowych pojedynczy gen koduje aktynę aktyny. Podczas organizmów wielokomórkowych różne geny kodują wiele isAformów aktyny.
Aktyna, wraz z miozyną, były kluczowymi strukturami w ewolucyjnej przyszłości organizmów eukariotycznych i ich dywersyfikacji, ponieważ pozwoliły na ruch przy braku innych struktur, takich jak flagella i rzęs.
[TOC]
Struktura: włókna aktynowe
Aktyna jest pojedynczym białkiem kulkowym łańcucha polipeptydowego. W mięśniu aktyna ma masę cząsteczkową około 42 kDa.
To białko ma dwie domeny. Każda z nich ma dwie subdomeny i rozszczep między domenami. ATP-MG+2 dołącza do dna rozszczepu. Terminale aminowe i karboksylowe łączą się w subdomena 1.
Actina G i Actina F
Istnieją dwie główne formy aktyny: monomer aktyny, zwany Actina G; i penlamentowy polimer, złożony z monomerów aktynnych, zwany Actina F. Włókna aktyny, obserwowane za pomocą mikroskopii elektronicznej, mają wąskie i szerokie regiony, odpowiednio o średnicy 7 nm i 9 nm.
W całym filamencie monomery aktynowe tworzą podwójną helisę ściskaną. Jednostka powtarzana w całym filamencie składa się z 13 śmigieł i 28 monomerów aktynowych i ma odległość 72 nm.
Filament aktyny ma dwa końce. Jeden tworzy rozszczep, który łączy ATP-MG+2, który znajduje się w tym samym kierunku we wszystkich monomerach aktynowych filamentu, zwany koniec (-); A drugi koniec jest odwrotny, zwany koniec (+). Dlatego mówi się, że filament aktyny ma polaryzację.
Wiele razy te składniki są znane jako mikrofilamenty, ponieważ są składnikami cytoszkieletu, które mają mniejszą średnicę.
Gdzie znajdujemy aktynę?
Aktyna jest niezwykle powszechnym białkiem w organizmach eukariotycznych. Spośród wszystkich białek komórkowych aktyna reprezentuje około 5 do 10% - w zależności od typu komórki. Na przykład w wątrobie każda z komórek, która ją tworzy, ma prawie 5.108 Cząsteczki aktyny.
Charakterystyka
Dwie formy aktyny, monomeru i filamentu są stale spotykane w dynamicznej równowagi między polimeryzacją a depolimerami. Ogólnie rzecz biorąc, istnieją trzy cechy tego zjawiska:
1) włókna aktyny są typowe dla struktury tkanki mięśniowej i cytoszkieletu komórek eukariotycznych.
Może ci służyć: 10 cech najwybitniejszych lipidów2) Polimeryzacja i depolimeryzacja to dynamiczny proces regulowany. Gdzie polimeryzacja lub agregacja monomerów aktyny G-ATP-MG+2 Zdarza się to na obu końcach. To, że proces ten występuje, zależy od warunków pożywki i białek regulacyjnych.
3) Tworzenie wiązek i siły, które tworzą cytoszkielet aktyny, daje siłę ruchliwości komórek. To zależy od białek uczestniczących w tworzeniu wiązań krzyżowych.
Funkcje
Skurcz mięśnia
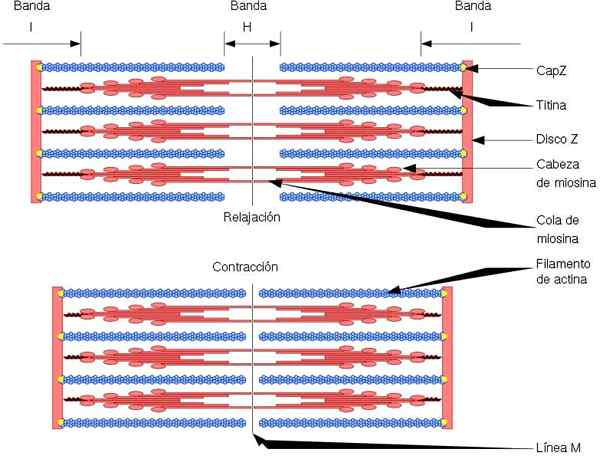
Funkcjonalną i strukturalną jednostką mięśnia szkieletowego jest sarkomen, który ma dwa rodzaje włókien: cienkie włókna, utworzone przez aktynę i grube włókna, utworzone przez miozynę. Oba włókna są zorganizowane naprzemiennie, w precyzyjny sposób geometryczny. Pozwól skurczemu mięśni.
Cienkie włókna są zakotwiczone w regionach zwanych dyskami z. Region ten składa się z sieci światłowodowej, w której znajduje się białko CAPZ, i do których zakotwiczone są końce (+) włókien aktyny. Ta kotwica zapobiega odkładaniu się końcowej (+).
Z drugiej strony, na końcach (-) włókien aktyny, tropomodulina jest zlokalizowana i chroni je przed depolimerą. Oprócz aktyny cienkie włókna mają tropomiozynę i troponinę, które mają funkcję kontrolowania interakcji aktomiozyny.
Jak występuje skurcz mięśni?
Podczas skurczu mięśni grube włókna wykonują ruchy obrotowe i ciągną cienkie włókna w kierunku środka sarkomeru. To wytwarza przesuwanie grubych i cienkich włókien.
Zatem długość grubej i cienkiej włókien pozostaje stała, ale zwiększa nakładanie się obu włókien. Długość sarcomera zmniejsza się przez zakotwiczenie cienkich włókien do dysków Z.
Jak zatrzymuje się skurcz mięśni?
ATP to waluta energetyczna komórki. Dlatego prawie zawsze jest dostępny w żywych tkankach mięśniowych. Biorąc pod uwagę powyższe, muszą istnieć mechanizmy umożliwiające rozluźnienie mięśni i aresztowanie skurczów.
Dwa białka, zwane tropomiozyną i troponiną, odgrywają fundamentalną rolę w tym zjawisku. Pracują one razem, aby zablokować strony związkowe miozyny (w ten sposób zapobiegając ich zjednoczeniu z aktyną). W rezultacie mięsień się rozluźnia.
Wbrew, gdy zwierzę umiera, doświadcza zjawiska znanego jako mortis rygor. Osoba odpowiedzialna za to stwardnienie ciała jest blokadą interakcji między miozyną a aktyną, krótko po śmierci zwierzęcia.
Jedną z konsekwencji tego zjawiska jest potrzeba ATP do uwalniania dwóch cząsteczek białka. Logicznie, nie ma dostępności ATP w martwych tkaninach, a ta wersja nie może wystąpić.
Inne rodzaje ruchu
Ten sam mechanizm, który opisujemy (później pogłębimy mechanizm leżący u podstaw ruchu) nie jest ograniczony do skurczów mięśni zwierząt. Jest odpowiedzialny za ruchy ameboidal, które obserwujemy w amebach i w niektórych formach kolonialnych.
W ten sam sposób ruch cytoplazmatyczny, który obserwujemy w glonach i roślinach lądowych, jest prowadzony przez podobne mechanizmy.
Regulacja polimeryzacji i depolimeryzacji filamentu aktyny
Skurcz tkanki mięśni gładkich i komórek powoduje wzrost aktyny i zmniejszenie aktyny G. Polimeryzacja aktyny zachodzi w trzech etapach: 1) zarodkowania, powolnym krokiem; 2) wydłużenie, szybki krok; oraz 3) stabilny status. Prędkość polimeryzacji jest równa szybkości depolimeryzacji.
Może ci służyć: teoria Fixist: koncepcja, postulaty i autorzyFilament aktyny rośnie szybciej do końca (+) niż koniec (-). Prędkość wydłużenia jest proporcjonalna do stężenia monomerów aktyny w równowadze z włóknami aktyny, zwaną stężeniem krytycznym (CC).
CC dla końca (+) wynosi 0,1 µm, a dla końca (-) wynosi 0,8 µm. Oznacza to, że wymagane jest 8 razy mniejsze stężenie monomerów aktyny do polimeryzacji końca (+).
Polimeryzacja aktyny jest regulowana głównie przez oszustwa beta4 (TB4). Białko to jednoczy aktynę i zachowuje je, zapobiegając polimeryce. Podczas gdy propylina stymuluje polimeryzację aktyny. Profil wiąże się z monomerami aktyny ułatwiającymi polimeryzację do końca (+), poprzez dysocjację kompleksu aktyny-TB4.
Inne czynniki, takie jak wzrost jonów (na+, K+ lub Mg+2) Faworyzuj tworzenie włókien.
Formacja cytoszkieletu aktyny
Tworzenie cytoszkieletu aktyny wymaga opracowania wiązań krzyżowych między włókienami aktyny. Te linki tworzą białka, których najważniejsze są: mają dziedziny unii do aktyny; Wiele z nich ma homologiczne domeny kalponiny; i każdy rodzaj białka jest wyrażany w określonym rodzaju komórce.
W filozodach i włókna stresu wiązania między włókienami aktynowymi są tworzone przez fascyna i filamina. Te białka odpowiednio sprawiają, że włókna aktyny są równoległe lub mają różne kąty. Dlatego włókna aktyny definiują kształt komórki.
Obszar komórkowy o najwyższej ilości włókien aktyny znajduje się w pobliżu błony plazmatycznej. Ten region nazywa się kory. Cytoszkielet korowy jest zorganizowany w różnych postaci.
Niektóre z najlepiej opisanych cytoszkieletów to komórki mięśniowe, płytki krwi, komórki nabłonkowe i erytrocyty. Na przykład w komórkach mięśniowych białko utrwalające dystrofinę łączy włókna aktyny z kompleksowym kompleksem glikoproteicznym błony. Ten kompleks wiąże się z białkami macierzy zewnątrzkomórkowej.
Model interakcji aktyny-miozyny
Naukowcy podlecili promieniowaniem, zaproponowali czterostopowy model w celu wyjaśnienia interakcji aktyny i miozyny. Pierwszy krok występuje wraz z związkiem ATP na głowicy miozyny. Ten związek generuje zmianę konformacyjną białka, uwalniając go z aktyny w małym filamencie.
Następnie ATP jest hydrolizowany do ADP, uwalniając nieorganiczny fosforan. Cząsteczka miozyny jest zakotwiczona w nowej podjednostce aktyny, generując stan wysokiej energii.
Uwolnienie nieorganicznego fosforanu przynosi ze sobą zmianę miozyny, powracając do początkowej konformacji i ruchu małych włókien, w odniesieniu do grubych włókien, w odniesieniu do grubych włókien. Ten ruch powoduje ruch dwóch końców sarkomenta, zbliżając się do nich.
Ostatni krok obejmuje wydanie ADP. W tym momencie głowa miozyny jest bezpłatna i może dołączyć do nowej cząsteczki ATP.
Może ci służyć: biologia: historia, jakie studia, gałęzie, podstawyRuch komórek napędzany przez polimeryzację aktyny
Rector Rector jest rodzajem ruchliwości komórek. Kroki tego rodzaju ruchliwości to: rzut wiodącej osi przyczepności do podłoża; przyczepność do podłoża; wycofanie tylne; i des-adhezja.
Projekcja wiodącej osi wymaga uczestnictwa w białkach, które uczestniczą w polimeryzacji i depolimeryzacji włókien aktyny. Oś wiodąca znajduje się w korze komórkowej, zwanej lamellipodio. Kroki projekcyjne osi to:
- Aktywacja receptora przez sygnał pozakomórkowy.
- Tworzenie aktywnych GTPASA i fosfoinozytolu 4,5-bishoposforanu (PIP2).
- WASP/SCRICE i APTATACJA Białka ARP2/3, które wiążą się z monomerami aktyny z wytworzeniem konsekwencji w włóknach aktyny.
- Szybki wzrost włókien aktyny, na końcu ozdobiony miozyną, rozgałęzieniem się. Pęd błony jest wytwarzany do przodu.
- Kulminacja wydłużenia wytwarzanego przez białka pokrywające.
- Hydroliza ATP przyłączona do aktyny w najstarszych włókienach.
- Depolimeryzacja aktyny-AD włókien promowanych przez ADF/Cofilina.
- Wymiana ADP przez ATP katalizowana przez profiline, generując aktynę G-ATP gotowe do rozpoczęcia Elongar Conseals.
Choroby związane z aktyną
Dystrofia mięśniowa
Dystrofia mięśni jest zwyrodnieniową chorobą mięśnia szkieletowego. Jest odziedziczony resezyjnie i jest powiązany z chromosomem X. Wpływa głównie na mężczyzn o wysokiej częstotliwości w populacji (jeden na 3.500 ludzi). Matki tych mężczyzn są bezobjawowe heterozygotyczne i mogą brakować historii rodziny.
Istnieją dwie formy dystrofii mięśni, Duchenne i Becker, i obie są spowodowane wadami w genie dystrofiny. Wady te składają się z delecji, które eliminują aksony.
Dystrofina jest białkiem (427 kDa), które tworzy wiązania krzyżowe między włóknami aktyny. Ma opanowanie związków aktynki w N-końcowym i opanowaniu związku błonowego w C-końcowym. Pomiędzy obiema domenami istnieje trzecia domena rurowa utworzona przez 24 tandem.
W kory mięśni retikulum dystrofina uczestniczy w związku włókien aktyny z błoną plazmatyczną poprzez kompleks glikoproteic. Ten kompleks wiąże się również z białkami macierzy pozakomórkowej.
U pacjentów bez funkcjonalnej dystrofiny, z dystrofią mięśniową Duchenne'a, cytoszkielet korowy nie obsługuje błony plazmatycznej. W związku z tym błona plazmatyczna jest uszkodzona przez stres powtarzających się skurczów mięśni.
Bibliografia
- Devlin, t.M. 2000. Biochemia. Redakcja Reverté, Barcelona.
- Gunst, s.J., i Zhang, W. 2008. Aktyna cytoszkieletowa dynamika w mięśniach gładkich: nowy paradygmat regulacji skurczu mięśni gładkich. Am J Physiol Cell Physiol, 295: C576-C587.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, s. 1., Baltimore, zm., Darnell, J. 2003. Biologia komórkowa i molekularna. Redakcja Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madryt, Meksyk, Sāo Paulo.
- Nelson, zm. L., Cox, m. M. 2008. Lehninger-Principles of Biochemistry. W.H. Freeman, Nowy Jork.
- Pfaendtner, j., Z krzyża i. M., Voth, g. 2010. Przebudowa filamentu aktyny przez czynnik depolimeryzacyjny aktyny/kofilina. PNA, 107: 7299-7304.
- Pollard, t.D., Borisy, g.G. 2003. Poruszalność komórkowa napędzana montażem i demontażem wypełniaczy aktyny. Komórka, 112: 453-465.
- « Apolipoproteiny, czym są, funkcje, typy
- Podstawowa struktura alkoholu, właściwości, nomenklatura, przykłady »

