Podstawowa struktura alkoholu, właściwości, nomenklatura, przykłady

- 3738
- 7
- Eugenia Czapla
A Alkohol podstawowy Jest to taki, w którym grupa hydroksylowa jest powiązana z pierwotnym węglem; To jest kowalencyjnie przymocowany węgiel do innego węgla i hydrogenów. Jego ogólna formuła to ROH, w szczególności RCH2Och, ponieważ istnieje tylko jedna grupa wynajmu r.
RCH Formuła R Group R2Och, to może być każdy: łańcuch, pierścień lub heteroatomy. Jeśli chodzi o łańcuch, krótki lub długi, dzieje się to przed najbardziej reprezentatywnymi pierwotnymi alkoholi; Wśród nich są metanol i etanol, dwa z najbardziej syntetyzowanych na poziomach przemysłowych.
 Słoik do piwa: Przykład wodnego roztworu alkoholu etylowego, pierwotnego alkoholu, w macierzy organicznej. Źródło: Engin Akyurt przez pexels.
Słoik do piwa: Przykład wodnego roztworu alkoholu etylowego, pierwotnego alkoholu, w macierzy organicznej. Źródło: Engin Akyurt przez pexels. Fizycznie są jak inne alkohole, a ich punkty gotowania lub fuzji zależą od stopnia ich konsekwencji; Ale chemicznie są najbardziej reaktywne. Ponadto jego kwasowość jest lepsza niż w przypadku alkoholi wtórnych i trzeciorzędowych.
Pierwotne alkohole doświadczają reakcji utleniania, stając się szeroką liczbą związków organicznych: estry i etery, aldehydy i kwasy karboksylowe. Mogą również ponieść reakcje odwodnienia, stając się alkenami lub olefinami.
[TOC]
Struktura pierwotnego alkoholu
Najbardziej reprezentatywne są pierwotne alkohole pochodzące z alkanów liniowych. Jednak w rzeczywistości każda struktura, zarówno liniowa, jak i rozgałęziona, można zaklasyfikować w tym typu alkohole, o ile grupa OH jest powiązana z CH2.
Tak więc strukturalnie wszyscy mają wspólną obecność grupy -ch2Och, zwany metylool. Charakterystyką i konsekwencją tego faktu jest to, że grupa OH jest mniej zapobiegana; Oznacza to, że może wchodzić w interakcje ze środowiskiem bez innych atomów utrudniających przestrzennie.
Ponadto mniej zapobiegane OH oznacza, że atom węgla, który go przenosi, Wybierz2, może ponieść reakcje zastępcze przez mechanizm SN2 (Bimolekularny, bez powstawania karbokacji).
Z drugiej strony OH z większą swobodą interakcji ze środowiskiem, tłumaczy się jako silniejsze interakcje międzycząsteczkowe (przez mosty wodorowe), co z kolei zwiększa temperaturę fuzji lub wrzenia.
Może ci służyć: wodorotlenek niklu (iii): struktura, właściwości, zastosowania, ryzykoZdarza się również z jego rozpuszczalnością w rozpuszczalnikach polarnych, o ile grupa R nie jest bardzo hydrofobowa.
Nieruchomości
Kwasowość
Pierwotne alkohole pochodzą z najbardziej kwaśnych. Aby alkohol zachowywał się jak kwas Brnsteda, jon H musi przekazać darowiznę+ do środka, aby powiedzieć wodę, stać się anionem alcoxekdem:
ROH + H2ZŁOTO- + H3ALBO+
Ujemne obciążenie czerwieni-, w szczególności RCH2ALBO-, Poczuj mniej odpychania ze strony elektronów dwóch wiązań C-H, niż przez elektrony wiązania C-R.
Grupa wynajmu następnie ćwiczy największą odpychanie, destabilizując RCH2ALBO-; ale nie tak bardzo w porównaniu z faktem, że jeśli istnieją dwie lub trzy grupy R, podobnie jak odpowiednio w przypadku alkoholi wtórnych i trzeciorzędowych.
Innym sposobem wyjaśnienia największej kwasowości pierwotnego alkoholu jest różnica w elektroonywatywności, tworzenie momentu dipolowego: h2Cδ+-ALBOδ-H. Tlen przyciąga gęstość elektroniczną, zarówno CH2 jak H; Pozytywne częściowe obciążenie węgla odpycha trochę wodoru.
Grupa R przenosi trochę swojej gęstości elektronicznej na CHO2, co pomaga zmniejszyć jego dodatnie obciążenie częściowe, a wraz z nim odpychanie dla obciążenia wodoru. Im więcej grup RA, tym niższe odpychanie, a zatem trend H, który ma zostać uwolniony jako H+.
PKA
Pierwotne alkohole są uważane za najsłabsze kwasy niż woda, z wyjątkiem alkoholu metylowego, co jest nieco silniejsze. PKA alkoholu metylowego wynosi 15,2; A pka alkoholu etylowego wynosi 16,0. Tymczasem woda PKA wynosi 15,7.
Jednak woda, która jest uważana za słaby kwas, podobnie jak alkohole, może dołączyć do h+ Przekształcić w jon hydrium, h3ALBO+; to znaczy zachowuje się jak baza.
W ten sam sposób pierwotne alkohole mogą wychwytywać wodór; szczególnie w niektórych reakcjach, które są jego własne, na przykład w ich transformacji w alkeny lub olefiny.
Reakcje chemiczne
Rent Formation Formation
Alkohole reagują z halogenami wodorowymi w celu wytworzenia alkilowo -halogenów. Reaktywność alkoholi przed halogenami wodorowymi opada w następującej kolejności:
Może ci służyć: węgielAlkohol trzeciorzędowy> alkohol wtórny> Alkohol pierwotny
ROH +HX => RX +H2ALBO
Rx jest pierwotnym halogenkiem alkilowym (wybierz3Cl, rozdz3Ch2Br itp.).
Innym sposobem na przygotowanie alkilowo -halogenomoru jest reakcja chlorku tionilo, syntetycznego odczynnika z pierwotnym alkoholem, który staje się chlorek alkilu. Chlorek tionilo (socl2) wymaga reakcji obecności pirydyny.
Ch3(Ch2)3Ch2OH +SOCL2 => Ch3(Ch2)3Ch2Cl +SO2 + HCl
Ta reakcja odpowiada fluorogenowaniu 1-penolu, aby stać się 1-clloropentano w obecności pirydyny.
Utlenianie pierwotnych alkoholi
Alkohole można utleniać do aldehydów i kwasów karboksylowych, w zależności od odczynnika. Chlorochromian pirydyniowy (PCC) utlenia pierwotny alkohol do aldehydu, przy użyciu dichlorometanu jako rozpuszczalnika (CH2Cl2):
Ch3(Ch2)5Ch2OH => Cho3(Ch2)5Coh
To jest utlenianie 1-heptanolu w 1-heptanalnym.
Tymczasem nadmanganian potasu (kmno4) alkohol najpierw alkohol, a następnie utleniony do aldehydu do kwasu karboksylowego. Gdy do utleniania alkoholi stosuje się nadpisanatyn potasu, należy unikać złamania łącza między węglemi 3 i 4.
Ch3(Ch2)4Ch2OH => Cho3(Ch2)4Cooh
To jest utlenianie 1-heksanolu do kwasu heksanowego.
Za pomocą tej metody trudno jest uzyskać aldehyd, ponieważ łatwo utlenia kwas karboksylowy. Podobna sytuacja obserwuje się, gdy kwas chromowy jest stosowany do utleniania alkoholi.
Formacja e éteres
Pierwotne alkohole mogą stać się eterami po podgrzaniu w obecności katalizatora, zwykle kwas siarkowy:
2 RCH2OH => RCH2Och2R +H2ALBO
Formacja epares organicznych
Kondensacja alkoholu i kwasu karboksylowego, estryfikacja Fishera, katalizowana przez kwas, wytwarza ester i wodę:
Może ci służyć: karbokacja: formacja, cechy, typy, stabilnośćR'OH +rcooh rcoor ' +h2ALBO
Dobrze znana reakcja to etanol z kwasem octowym, aby nadać octan etylu:
Ch3Ch2OH +CH3Cooh ch3Coohch2Ch3 + H2ALBO
Alkohol pierwotny jest najbardziej podatny na reakcje steryfikacji Fischera.
Odwodnienie
W wysokich temperaturach i w pożywce kwaśnej, zwykle kwas siarkowy, alkohole odwadniają się.
Ch3Ch2OH => H2C = CH2 + H2ALBO
To jest reakcja odwodnienia etanolu na etylen. Bardziej odpowiednią ogólną formułą dla tego rodzaju reakcji, szczególnie dla alkoholu pierwotnego, byłoby:
RCH2Oh => r = cho2 (Co jest również równe RC = CH2)
Nomenklatura
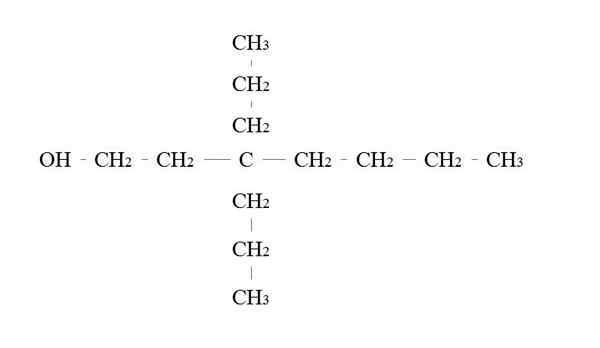 Podstawowy przykład alkoholu. Źródło: Gabriel Bolívar.
Podstawowy przykład alkoholu. Źródło: Gabriel Bolívar. Zasady nazwania pierwotnego alkoholu są takie same jak w przypadku innych alkoholi; Z wyjątkiem, że czasami nie jest konieczne wyliczenie nośnika OH.
Na górnym obrazie znajduje się główny siedmiokę węglowy. Węgiel powiązany z OH jest przypisany liczbą 1, a następnie zaczyna liczyć się od lewej do prawej. Jego nazwa IUPAC to zatem: 3.3-dietilheptanol.
Zauważ, że jest to przykład wysoce rozgałęzionego alkoholu pierwotnego.
Przykłady
Wreszcie, niektóre podstawowe alkohole są wymienione zgodnie z ich tradycyjną i systematyczną nomenklaturą:
-Metyl, rozdz3Oh
-Etyl, rozdz3Ch2Oh
-N-propyl, rozdz3Ch2Ch2Oh
-N-heksyl, rozdz3Ch2Ch2Ch2Ch2Ch2Oh
Pochodzą one z alkanów liniowych. Inne przykłady to:
-2-fenyletanol, c6H5Ch2Ch2Och (c6H5 = pierścień benzenowy)
-2-Propen-1-OC (alkohol alliczny), Cho2= Chch2Oh
-1,2-taodiol, rozdz2Ohch2Oh
-2-chloroetanol (etylelekhorhydryna), clch2Ch2Oh
-2-Buten-1-OL (alkohol crotilic), CH3CH = CHCH2Oh
Bibliografia
- Morrison, r.T. I Boyd, r. N. (1987). Chemia organiczna. (5ta Wydanie). Addison-Wesley Iberoamericana
- Carey, f. DO. (2008). Chemia organiczna. (6ta Wydanie). McGraw-Hill, Intermerica, redakcje.DO.
- Mel Science. (2019). Jak odbywa się utlenianie pierwotnych alkoholi. Odzyskane z: Melscience.com
- Royal Society of Chemistry. (2019). Definicja: Podstawowe alkohole. Odzyskane z: RSC.org
- Chriss e. McDonald. (2000). Utlenianie pierwotnych alkoholi do estrów: trzy powiązane eksperymenty śledcze. J. Chem. Edukacja., 2000, 77 (6), s. 750. Doi: 10.1021/ED077P750
- « Charakterystyka aktyny, struktura, włókna, funkcja
- Materiały diamagnetyzmu, aplikacje, przykłady »

