Struktura, funkcje i inhibitory acetylocholinesterazy
- 4485
- 1358
- Gabriela Łuczak
acetylocholinesteraza (Acetylocholina acetylsa hydrolesee, EC 3.1.1.7) Jest to enzym, który jest głównie w ośrodkowym układzie nerwowym. Jego zadaniem, jak sama nazwa wskazuje, jest przetwarzanie hydrolityczne neuroprzekaźnika acetylocholiny.
Jest to enzym związany z błoną komórkową, który współpracuje z odbiornikiem acetylocholiny w celu pośredniczenia w wzbudzeniu komórek postsynaptycznych i którego mechanizm katalityczny jest zaskakująco szybki.
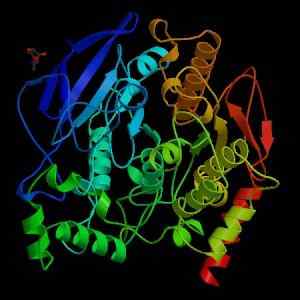
 Struktura acetylocholinesterazy (źródło: Wikimedia Commons)
Struktura acetylocholinesterazy (źródło: Wikimedia Commons) Z mechanicznego punktu widzenia enzym ten można postrzegać jako serin-hydrolazę, aw domenie katalitycznej w jej miejscu aktywnym zawiera triadę aminokwasów charakterystyczną dla proteazy: seryny, histydyny i resztki kwasu. Jednak kwaśna pozostałość jest glutaminianem, podczas gdy proteazy zwykle mają asparaginian.
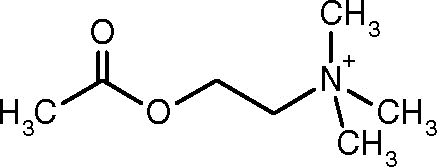 Struktura acetylocholiny (Źródło: ALinebloom [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Struktura acetylocholiny (Źródło: ALinebloom [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Jedną z pierwszych obserwacji, które łączyły katalityczną aktywność acetylocholinesterazy z cholinergicznymi tkankami nerwowymi i tkankami mięśniowymi, było to, że Dale w 1914 r.; Następnie ustalono, że występuje również w neuronach niellorycznych oraz w komórkach hematopoetycznych, osteogennych i nowotworowych.
Dzięki badaniu różnych organizmów wiadomo obecnie, że enzym jest obecny w błonie różnych rodzajów komórek, takich jak erytrocyty, komórki nerwowe i mięśniowe, narządy elektryczne i inne.
[TOC]
Struktura
Struktura trzeciorzędowa i czwartorzędowa
W naturalnych warunkach lub "in vivo ", Acetylocholinoesteraza jest enzymem polimorficznym, który składa się z kilku katalitycznych podjednostek o mniej więcej 80 kDa, które są składane w celu utworzenia struktury oligomerycznej (kilku podjednostek).
Ilość i złożoność tych podjednostek zależy od rodzaju komórki i rozważanych gatunków.
Niektóre z najbardziej złożonych form enzymatycznych mają katalityczne podjednostki o formach kulistych (g) lub asymetrycznych (a) połączonych mostami disiarczkowymi. Mosty disiarczkowe są wiązaniami kowalencyjnymi utworzonymi między dwoma cząsteczkami siarki grup tiol (-SH) dwóch resztek kwasu cysteinowego.
Każdy podjednostka G zawiera pojedyncze miejsce aktywne, podczas gdy podjednostki A są zwykle charakteryzowane przez przedstawianie trzech domen strukturalnych, a mianowicie: katalityczne podjednostki, kolagenowe ogony bogate w glicynę, hydroksyprolinę i marnotrawstwo hydroksylisin, a inne nietopelagenowe ogony (różne od kolagenu).
Asymetryczne formy acetylocholinesterazy są znane jako A12, A8 i A4, które mają odpowiednio 12, 8 i 4 podjednostki katalityczne.
Może ci służyć: flora i fauna z Afryki: reprezentatywne gatunkiZasadniczo reszty domeny katalitycznej w miejscu aktywnym znajdują się w „głębokim” regionie podjednostek, co można było postrzegać jako sprzeczne w odniesieniu do szybkiej prędkości reakcji, która katalizuje ten enzym i pozorną niedostępność podłoża do podłoża do podłoża do podłoża do podłoża te strony.
Niezależnie od polimorfizmu enzymu, zarówno podjednostki kuliste, jak i asymetryczne mają podobne czynności katalityczne.
Warianty
Niektóre komórki inne niż komórki nerwowe, ponieważ erytrocyty wytwarzają głównie kulinarne, dimetryczne i głównie związane z enzymami acetylocholinestowymi o zewnętrznej powierzchni błony plazmatycznej.
Enzym erytrocytów, choć o mniejszej złożoności strukturalnej, jest również enzymem amfipatycznym, którego aktywna domena katalityczna występuje w dużym regionie hydrofilowym, podczas gdy domena hydrofobowa, która zawiera końcowy region karboksylowy, jest odpowiedzialny za utrzymanie go w błonie.
Struktura pierwotna
Wiele obecnych wiedzy na temat sekwencji acetylocholinesterazy powstało z badania enzymu Californica Torpedo, Ryba linii, która żyje na Oceanie Spokojnym i która była tradycyjnie stosowana jako modelowy organizm do badania różnych białek układu nerwowego.
Podjednostki acetylocholinesterazy są syntetyzowane jako pro-białka, które są następnie przetwarzane w celu uzyskania dojrzałych podjednostek. Każda podjednostka składa się z polipeptydu około 575 aminokwasów i 65 kDa masy cząsteczkowej, co wzrasta o dodanie 7-8% odpadów węglowodanów (glikozylacja).
Aktywność katalityczna miejsca aktywnego podjednostek jest określana przez resztę serynową w pozycji 200, która znajduje się w „głębokim” regionie podjednostek katalitycznych.
Różne warianty lub izoformy enzymu istnieją w organizmach dzięki różnym miejscom dla "alternatywne splicing ” posłańców przed aranem na obu ich końcach (5 'i 3'). Karboksylowo-końcowa sekwencja izoformu każdej podjednostki jest tą, która określa ze sobą montaż oligomerów.
Funkcje
Acetylocholinesteraza jest enzymem z wieloma funkcjami biologicznymi, niekoniecznie związanymi ze sobą. Potwierdzony przez jego różnicową ekspresję podczas embriogenezy, embrionalnego przedłużenia nerwowego, rozwoju mięśni i synptogenezy.
Jak wcześniej podkreślono, ma ważną funkcję w szybkiej hydrolizy acetylocholiny, a zatem w regulacji jej wpływu na neuromięśniową przestrzeń synaptyczną lub w kolorycznych przestrzeniach synaptycznych ośrodkowego układu nerwowego ośrodkowego układu nerwowego.
Może ci służyć: aplikacje biologiczne w hodowliPrzykładem jego funkcji jest skurcz mięśnia szkieletowego, który występuje dzięki rodzajem synapsy chemicznej znanej jako płytka motoryczna, położona między neuronem ruchowym a włóknem mięśniowym.
W tej synapsie osiąga się setki pęcherzyków obciążonych acetylocholiną, które są uwalniane z neuronu ruchowego w celu rozprzestrzeniania impulsu elektrycznego.
Ten proces neurotransmisji jest dość złożony, jednak udział acetylocholinoesterazy ma kluczowe znaczenie dla zakończenia transmisji synaptycznej, która zależy od neuroprzekaźnika acetylocholiny, ponieważ należy go degradować, a następnie rozprzestrzeniać się poza rozszczep synaptycznym w celu komponowania z podekscytowaniem błony.
Zatem enzym acetylocholinesterazy jest odpowiedzialny za regulację stężenia tego nadajnika w synapsie neuromotory.
Inne „nieklasyczne” funkcje enzymu są związane z neuritogenezą lub wzrostem komórek nerwowych; Z procesami adhezji komórkowej, synaptogenezą, aktywacją neuronów-dopaminy w czarnej substancji śródmózgowia, procesów hematopoetyczny.
Inhibitory
Działają inhibitory acetylocholinoesterazy, które są hydrolizowane do acetylocholiny, zwiększając w ten sposób poziom i czas działania tego neuroprzekaźnika. Można je klasyfikować, zgodnie z ich mechanizmem działania, jako odwracalne i nieodwracalne.
Nieodwracalne inhibitory
Są to te, które nieodwracalnie hamują aktywność hydrolityczną acetylocholinesterazy z powodu ich kowalencyjnego połączenia z resztą seryny w aktywnym miejscu enzymu. Ta grupa składa się głównie z fosforoorganicznego.
Ogólnie rzecz biorąc, są to związki czynne obecne w wielu środkach owadobójczych i są odpowiedzialne za dużą liczbę przypadkowych zgonów z powodu zatrucia. Są to estry lub tiole pochodzące z fosforycznego, fosfonicznego, fosfiny lub kwasu fosforowego.
Sarina, tabun, soman i cyklosaryna należą do najbardziej toksycznych związków syntetyzowanych przez człowieka, ponieważ mogą one zabić człowieka poprzez indukowanie awarii oddechowych i krążenia z powodu blokady acetylocholinesterazy w obwodowym układzie nerwowym.
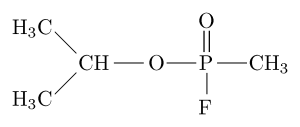 Struktura molekularna inhibitora fosforoorganicznego „Sarín” (źródło: Sivizius [domena publiczna] przez Wikimedia Commons)
Struktura molekularna inhibitora fosforoorganicznego „Sarín” (źródło: Sivizius [domena publiczna] przez Wikimedia Commons) Na przykład sarin jest „gazem nerwowym”, który został użyty jako broń chemiczna do użytku terrorystycznego.
Odwracalne inhibitory
Ta kolejność grup klasyfikacyjnych konkurencyjnych i niekonkurencyjnych inhibitorów, które działają przez przejściową i odwracalną karbamilację pozostałości seryny w miejscu aktywnym, a wiele z nich zostało zsyntetyzowane i oczyszczone ze źródeł roślinnych lub grzybiczych.
Może ci służyć: Sokes: Charakterystyka, struktura, funkcjeKarbamaty, takie jak physostigmina i neostygmina, są odwracalne inhibitory, które są stosowane jako leki w leczeniu chorób, takich jak jaskra i miastenia gravis.
Inne środki terapeutyczne tej grupy są również stosowane w leczeniu choroby Alzheimera, Parkinsona Parkinsona, niedrożności jelit pooperacyjnych (pooperacyjnym jelicie jelitym), rozszerzeniu pęcherza i jako antidotum do przedawkowania antycholinergicznym.
Butirilcolinesteraza
Interesujący naturalny mechanizm wobec niektórych hamujących substancji acetylocholinesterazy ma związek z udziałem mniej specyficznego enzymu znanego jako butirilcolinesteraza.
Ten enzym jest również w stanie hydrolizować.
Acetylocholinesteraza i choroba Alzheimera
Wykazano, że acetylocholinoesteraza tworzy stabilny kompleks z elementami cech starszych patologii. Ponadto pewne zmienione wzory glikozylacji tego enzymu były związane z obecnością i tworzeniem się płytek amyloidowych w mózgu.
Dlatego wiele odwracalnych inhibitorów acetylocholinesterazy zostało zatem stosowanych jako leki pierwszej generacji w leczeniu tej choroby i innych powiązanych stanów neurodegeneracyjnych. Wśród nich są Donepezilo, Rivastigmina i Galantamine.
Bibliografia
- Dvir, h., Silman, ja., Harel, m., Rosenberry, t. L., & Sussman, J. L. (2010). Acetylocholinesteraza: od struktury 3D do funkcjonowania. Interakcje chemiczne-biologiczne, 187, 10-22.
- Houghton, s. 1., Ren i., & Howes, m. (2006). Inhibitory acetylocholinesterazy z roślin i grzybów. Raporty o produktach naturalnych, 23, 181-199.
- Krsti, zm. Z., Lazarevi, t. D., Bond, a. M., & Vasi, v. M. (2013). Inhibitory acetylocholinesterazy: farmakologia i toksykologia. Obecna neurofarmacja, jedenaście, 315-335.
- Mukherjee, s. 1. K., Kumar, v., Bad, m., & Houchton, p. J. (2007). Inhibitory acetylocholinesterazy z roślin. Fitomedycyna, 14, 289-300.
- Quinn, zm. M. (1987). Acetylocholinesteraza: struktura enzymu, dynamika reakcji i wirtualne stany przejściowe. Chem. Obrót silnika., 87, 955-979.
- Racchi, m., Mazzucchelli, m., Porrello, e., Lanni, c., I Govoni, s. (2004). Inhibitory acetylocholinesterazy: nowe aktywność starych cząsteczek. Badania farmakologiczne, pięćdziesiąt, 441-451.
- Rosenberry, t. (1975). Acetylocholinesteraza. Postęp w enzymologii i powiązanych obszarach biologii molekularnej, 43, 103-218.
- SOREQ, godz., & Seidman, s. (2001). Acetylocholinesteraza - nowe role dla starego aktora. Recenzje przyrody, 2, 294-302.
- Tales, v. N. (2001). Acetylocholinesteraza w chorobie Alzheimera. Mechanizmy starzenia się i rozwoju, 122, 1961-1969.

