Yoduro, ale charakterystyka, struktura, funkcje
- 4339
- 167
- Marianna Czarnecki
Peroksydaza joduro lub peroksydaza tarczycy (TPO) jest hemo-glikoproteiną należącą do rodziny peroksydaz ssaków (takich jak mieloperoksydaza, laktoperoksydaza i inne), która uczestniczy w drodze syntezy hormonu tarczycy.
Jego główną funkcją jest „jodowanie” odpadów tyrozynowych w tyoglobulinie i tworzenie 3-3'-5-trijodotyroniny (T3) i tyrozinów tyrozin 3-3-5.
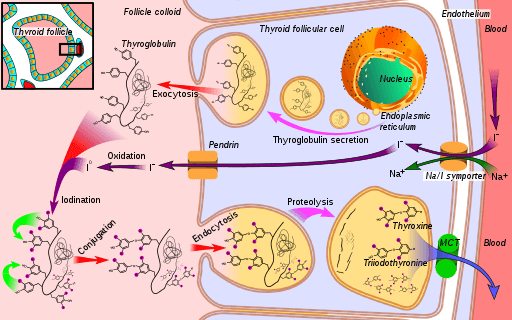
 Schemat trasy biosyntetycznej hormonu tarczycy, w której peroksydaza jodku (w utlenianiu jodku do jodu) (Źródło: Mikael Häggström [CC0] przez Wikimedia Commons)
Schemat trasy biosyntetycznej hormonu tarczycy, w której peroksydaza jodku (w utlenianiu jodku do jodu) (Źródło: Mikael Häggström [CC0] przez Wikimedia Commons) Triiodyronina i tyroksyna to dwa hormony wytwarzane przez tarczycę, które mają niezbędne funkcje w rozwoju, różnicowaniu i metabolizmie ssaków. Jego mechanizm działania zależy od interakcji receptorów jądrowych ze specyficznymi sekwencjami genów jego białych genów.
Istnienie enzymu peroksydazy Yoduro zostało potwierdzone w latach 60. XX wieku przez różnych autorów i obecnie dokonano znacznych postępów w zakresie określenia jego struktury, jej funkcji i charakterystyk genu, który koduje go w różnych organizmach.
W większości literatury związanej z tym enzymem jest to znane jako mikrosomalny „autoantygen” i jest związany z niektórymi chorobami autoimmunologicznymi tarczycy.
Dzięki jego charakterystyce immunogennym enzym ten jest białą lub docelową cząsteczką.
[TOC]
Charakterystyka
Jodek peroksydazy jest kodowany przez gen zlokalizowany na chromosomie 2 ludzi, który mierzy ponad 150 kpb i składa się z 17 eksonów i 16 intronów.
To transmbraalne białko, z jednym segmentem zanurzonym w błonie, jest ściśle związane z mieloperoksydazą, z którymi ma ponad 40% podobieństwa sekwencji aminokwasowej.
Może ci służyć: acyloglicerydy: cechy, struktura, typy, funkcjeJego synteza występuje w polirybosomach (zestaw rybosomów odpowiedzialnych za tłumaczenie tego samego białka), a następnie jest wstawiana do błony endoplazmatycznej retikulum, gdzie przechodzi przez proces glikozylacji.
Po zsyntetyzowaniu i glikozylowanej jodaz peroksydazy jest transportowany na wierzchołkowy biegun pull (komórki tarczycy lub komórki tarczycy), gdzie jest w stanie odsłonić jego katalityczne centrum w kierunku światła pęcherzykowego tarczycy tarczycy.
Regulacja ekspresji
Ekspresja genu kodującego tarczycy lub peroksydazy jodku jest kontrolowana przez określone czynniki transkrypcyjne tarczycy, takie jak TTF-1, TTF-2 i PAX-8.
Elementy genetyczne, które pozwalają na zwiększenie lub zwiększenie ekspresji tego genu u ludzi, zostały opisane w regionach, które flankują koniec 5 'tego samego, zwykle spośród pierwszych 140 par zasad tego regionu „Fanqueante”.
Istnieją również elementy, które tłumią lub zmniejszają ekspresję tego białka, ale w przeciwieństwie do „potencjalnych”, zostały one opisane poniżej sekwencji genów.
Znaczna część regulacji genetycznej ekspresji peroksydazy jodku występuje w sposób specyficzny dla tkanki, co zależy od działania elementów Unii DNA, które działają Cis, takie jak czynniki transkrypcyjne TTF-1 i inne.
Struktura
To białko z aktywnością enzymatyczną ma około 933 odpadów aminokwasowych i zewnątrzkomórkowy C-końcowy koniec 197 aminokwasów, które pochodzą z ekspresji innych modułów genów, które kodują dla innych glikoprotein.
Jego masa cząsteczkowa wynosi około 110 kDa i jest częścią glikozylowanej grupy białek transbranowych typu 1, ponieważ ma glikozylowany segment transbłonowy i grupę HEMO w aktywnym miejscu aktywnym.
Może ci służyć: gruczoły: typy, funkcja, stan zapalny i chorobyStruktura tego białka ma przynajmniej mostek disiarczkowy w obszarze pozakomórkowym, który tworzy charakterystyczną zamkniętą pętlę, która jest odsłonięta na powierzchni tirocytów.
Funkcje
Główna fizjologiczna funkcja jodazy peroksydazy jest związana z jej udziałem w syntezie hormonu tarczycy, gdzie katalizuje „iodation” odpadów tyrozyny monoodotyrozyny (MIT) i diousyrozyny (DIT), oprócz połączenia iodirozyny z tyrozyny przez monoodotyrozynę (MIT) i diousyrozyna (DIT) Pozostałości w tyoglobulinie.
Jaka jest synteza hormonu tarczycy?
Aby zrozumieć funkcję enzymu peroksydazy tarczycy, konieczne jest rozważenie etapów syntezy hormonalnej, w której uczestniczy:
1 siadanie z transportem jodku do tarczycy i kontynuuje
2-wytwarzanie środka utleniającego, takiego jak nadtlenek wodoru (H2O2)
3-POOROOLNIE białko odbiorcze jest syntetyzowane, tyoglobulina
4-yoduro jest utleniany do stanu starszej walencji i później
5-Yoduro jest połączone z odpadami tyrozynowymi obecnymi w tyoglobulinie
6-In Thyoglobulina, jodoteze (rodzaj hormonów tarczycy) powstaje z powodu sprzężenia odpadów ryodothic
7-Thyoglobulina jest przechowywana i wypita
8-jodirosinas jodirosinas jest usuwany i na koniec,
9-thiroksyna jest uwalniana i trijodotyron w kierunku krwi; Hormony te wywierają wpływ na interakcję z ich specyficznymi receptorami, które znajdują się w błonie jądrowej i są w stanie oddziaływać z białymi sekwencjami DNA, funkcjonując jako czynniki transkrypcyjne.
Jak można by oderwać od wiedzy o funkcjach dwóch hormonów, których synteza uczestniczy (T3 i T4), jodaz peroksydazy ma ważne implikacje na poziomie fizjologicznym.
Brak obu hormonów podczas rozwoju człowieka powoduje wady wzrostu i upośledzenia umysłowego, a także nierównowagi metaboliczne w życiu dorosłym.
Może ci służyć: holoenzyme: Charakterystyka, funkcje i przykładyPowiązane choroby
Jodek peroksydazy jest jednym z głównych autoantygenów tarczycy u ludzi i jest związany z cytotoksycznością za pośrednictwem układu dopełniacza. Jego funkcja jako autoantygen wyróżnia się u pacjentów z chorobami autoimmunologicznymi tarczycy.
Na przykład choroba gej wynika z niedoboru zawartości jodu podczas syntezy hormonalnej w tarczycy, która została powiązana z produktem niedoboru jodowania tyroglobuliny niektórych w niektórych defektach peroksydazy peroksydazy peroksydazy peroksydazy.
Niektóre rak charakteryzują się zmienionymi funkcjami jodkiem peroksydazy, to znaczy poziomy aktywności tego enzymu są znacznie niższe niż u pacjentów spoza rangi.
Jednak badania potwierdziły, że jest to niezwykle zmienna cecha, która zależy nie tylko od pacjenta, ale od rodzaju raka i dotkniętych regionów.
Bibliografia
- DeGroot, L. J., & Niepomniszfon, H. (1977). Biosynteza hormonu tarczycy: aspekty podstawowe i kliniczne. Postęp w endokrynologii i metabolizmie, 26(6), 665-718.
- Fragu, s. 1., & Nataf, b. M. (1976). Ludzka aktywność peroksydazy tarczycy w łagodnych i złośliwych zaburzeniach tarczycy. Towarzystwo endokrynologiczne, Cztery pięć(5), 1089-1096.
- Kimura, s., I ikeda-saito, m. (1988). Ludzkie mieloperoksydae i peroksydaza tarczycy, dwa enzymy o oddzielnych i odrębnych funkcjach fizjologicznych, są ewolucyjnymi członkami tej samej rodziny genów genów. Białka: struktura, funkcja i bioinformatyka, 3, 113-120.
- Nagasaka, a., Hidaka, godz., I Ishizuki, i. (1975). Badania nad peroksydazą jodku ludzkiego: jej aktywność w różnych zaburzeniach tarczycy. Ustawa o chemicznej klinice, 62, 1-4.
- Ruf, J., I CARAYON, P. (2006). Strukturalne i funkcjonalne aspekty peroksydazy tarczycy. Archiwa biochemii i biofizyki, 445, 269-277.
- Ruf, J., Toubert, m., Czarnoca, ur., Durand-Gorde, m., Ferrand, m., I CARAYON, P. (2015). Związek między strukturą immunologiczną a właściwościami biochemicznymi ludzkiej peroksydazy tarczycy. Recenzje endokrynologiczne, 125(3), 1211-1218.
- Taurog, a. (1999). Ewolucja molekularna peroksydazy tarczycy. Biochimie, 81, 557-562.
- Zhang, J., & Lazar, m. DO. (2000). Mechanizm działania hormonów tarczycy. Annu. Obrót silnika. Physiol., 62(1), 439-466.

