Struktura tlenku krzemu (SiO2), właściwości, stosowanie, uzyskiwanie

- 3419
- 260
- Maksymilian Kępa
On Tlenek krzemu Jest to nieorganiczna substancja stała utworzona przez połączenie atomu krzemu i dwa tlenie. Jego formuła chemiczna to SIO2. Ten naturalny związek nazywany jest również dwutlenkiem krzemowym lub krzemowym.
Sio2 Jest to najliczniejszy minerał w skórce Ziemi, ponieważ piasek składa się z krzemionki. Zgodnie z jego strukturą krzemionkę może być krystaliczna lub amorficzna. Jest nierozpuszczalny w wodzie, ale rozpuszcza się w zasadach i kwasu fluorowym HF.
 Piasek jest źródłem silikonowego dwutlenku SIO2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Piasek jest źródłem silikonowego dwutlenku SIO2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Sio2 Jest również obecny w strukturze niektórych roślin, bakterii i grzybów. Również w szkieletach organizmów morskich. Oprócz piasku istnieją również inne rodzaje kamieni, które są krzemionką.
Krzemionka ma bardzo rozpowszechnione użycie wypełniania różnych funkcji. Najbardziej rozpowszechnione jest filtrowanie materiałów płynów, takich jak oleje i produkty olejowe, napoje, takie jak piwo i wino, a także soki owocowe.
Ale ma wiele innych aplikacji. Jednym z najbardziej przydatnych i ważnych jest produkcja szkła bioaktywnego, które umożliwiają „rusztowanie”, w którym komórki kostne rosną w celu wytwarzania brakujących części kości z powodu wypadku lub choroby.
[TOC]
Struktura
Dwutlenek Silicio Sio2 Jest to cząsteczka trzech atomów, w której atom krzemowy jest powiązany z dwoma atomami tlenu z kowalencyjnymi wiązaniami.
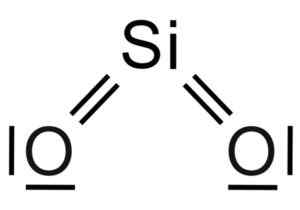 Struktura chemiczna cząsteczki SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Struktura chemiczna cząsteczki SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Jednostka strukturalna stałej krzemionki jako taka jest tetrahedron, w którym atom krzemowy jest otoczony 4 atomami tlenu.
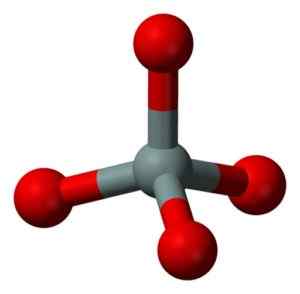 Jednostka strukturalna stałej krzemionki: szary = krzem, czerwony = tlen. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Jednostka strukturalna stałej krzemionki: szary = krzem, czerwony = tlen. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Tetrahedry wiążą się ze sobą, dzieląc atomy tlenu ich przyległych wierzchołków.
Właśnie dlatego atom krzemowy dzieli połowę każdego z 4 atomów tlenu, co wyjaśnia stosunek w związku 1 atomu krzemu w 2 atomach tlenu (SIO2).
 Tetrahedra dzielą tlen w SIO2. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Tetrahedra dzielą tlen w SIO2. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Związki SIO2 Są one podzielone na dwie grupy: krystaliczna krzemionka i amorficzna krzemionka.
Związki krzemionki krystalicznej mają struktury o powtarzających się wzorach krzemu i tlenu.
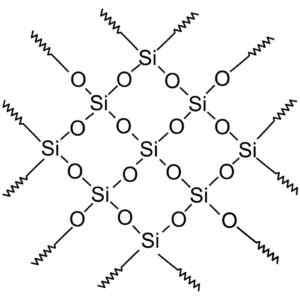 Krystaliczna krzemionka ma powtarzające się jednostki. Wersję rastrową WYKONAl użytkowlik PolSKiego PROJEKTU Wikipedii: Polyimerek, ZwektoryzowAl: Krzysztof Zajączkowski [gfdl (http: // wwww.gnu antylopa.Org/copyleft/fdl.html)]. Źródło: Wikimedia Commons.
Krystaliczna krzemionka ma powtarzające się jednostki. Wersję rastrową WYKONAl użytkowlik PolSKiego PROJEKTU Wikipedii: Polyimerek, ZwektoryzowAl: Krzysztof Zajączkowski [gfdl (http: // wwww.gnu antylopa.Org/copyleft/fdl.html)]. Źródło: Wikimedia Commons. Cały kryształ krzemionki można uznać za gigantyczną cząsteczkę, w której sieć krystaliczna jest bardzo silna. Tetrahedra można połączyć na różne sposoby, co daje różne formy krystaliczne.
Może ci służyć: sieci Bravais: koncepcja, cechy, przykłady, ćwiczeniaW amorficznej krzemionce struktury są losowo powiązane, bez przestrzegania regularnego wzoru między cząsteczkami i są one w innym związku przestrzennym.
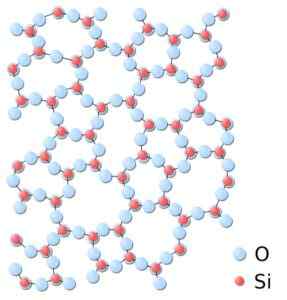 W amorficznej krzemionce związki nie są powtarzalne ani jednolite. Krzemionka.Svg: *krzemionka.JPG: W: Użytkownik: JDREWITTDERIVEVATION Praca: Matt [domena publiczna]. Źródło: Wikimedia Commons.
W amorficznej krzemionce związki nie są powtarzalne ani jednolite. Krzemionka.Svg: *krzemionka.JPG: W: Użytkownik: JDREWITTDERIVEVATION Praca: Matt [domena publiczna]. Źródło: Wikimedia Commons. Nomenklatura
-Tlenek krzemu
-Dwutlenek krzemu
-Krzemionka
-Kwarc
-Tridimita
-Cristobalita
-DiOxosilano
Nieruchomości
Stan fizyczny
Kolor bezbarwny do szarości.
 Próbka SIO2 czysty. Lhchem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Próbka SIO2 czysty. Lhchem [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Waga molekularna
60 084 g/mol
Temperatura topnienia
1713 ° C
Punkt wrzenia
2230 ° C
Gęstość
217-2,32 g/cm3
Rozpuszczalność
Nierozpuszczalne w wodzie. Amorficzna krzemionka jest rozpuszczalna w alkalii, zwłaszcza jeśli jest drobno podzielona. Rozpuszczalne w kwasu fluorhorowym HF.
Amorficzna krzemionka jest mniej hydrofilowa, to znaczy mniej związana z wodą niż krystaliczna.
Właściwości chemiczne
Sio2 o krzemionka jest zasadniczo obojętna dla większości substancji, jest bardzo mało reaktywna.
Opiera się ataku chloru CL2, Bromo br2, Wodór h2 i większości kwasów w temperaturze pokojowej lub nieco wyższa. Jest atakowany przez fluor f2, Kwas fluorhorowy HF i alkalis, takie jak węglan sodu2WSPÓŁ3.
Sio2 Można go połączyć z metalowymi pierwiastkami i tlenkami, aby utworzyć krzemiany. Jeśli krzemionka topi się węglanami metali alkalicznych w około 1300 ° C, uzyskuje się krzemiany alkaliczne2.
To nie jest paliwo. Ma niską przewodność cieplną.
Obecność w naturze
Głównym źródłem krzemionki w naturze jest piasek.
Sio2 o krzemionka ma postać trzech odmian krystalicznych: kwarc (najbardziej stabilny), Tridimita i Cristobalita. Amorfant na krzemionkę to Agata, Jaspe i Ónice. Opal to amorficzna nawilżona krzemionka.
Istnieje również kalonowana biogeniczna krzemionka, to znaczy ta generowana przez żywe organizmy. Źródła tego typu krzemionki to bakterie, grzyby, okrzemki, gąbki morskie i rośliny.
Jasne i twarde części bambusa i słomy zawierają krzemionkę, a szkielety niektórych organizmów morskich mają również dużą część krzemionki; Jednak najważniejsze są okręgi.
Ziemie Diatomea to produkty geologiczne zepsutych organizmów jednokomórkowych (glony).
Może ci służyć: kosmiczny kurzInne rodzaje naturalnej krzemionki
W naturze istnieją również następujące odmiany:
- Szkliste krzemiany, które są szkłem wulkanicznym
- Milleritas, które są naturalnym szkłem wytwarzanym przez fuzję materiału krzemionkowego pod wpływem meteorytów
- Stopiona krzemionka, która jest ogrzana krzemionka do cieczy i chłodzonej fazy bez dopuszczania krystalicznego
Uzyskanie
Krzemionka z areny jest uzyskiwana bezpośrednio z kamieniołomów.
 Kamieniołom areny w Kalifornii. Ruff Tux Cream Puff [CC0]. Źródło: Wikimedia Commons.
Kamieniołom areny w Kalifornii. Ruff Tux Cream Puff [CC0]. Źródło: Wikimedia Commons. W ten sposób uzyskiwane są również okręgi lub okrzemki, przy użyciu podobnych koparów i sprzętu.
Amorficzną krzemionkę jest przygotowywana na podstawie wodnych roztworów krzemianu metalu alkalicznego (takiego jak sodowe na) przez neutralizację kwasem, takim jak kwas siarkowy H2południowy zachód4, HCl kwas wodny lub dwutlenek węgla2.
Jeśli ostateczne pH roztworu jest neutralne lub alkaliczne, uzyskuje się krzemionkę wytrąconą. Jeśli pH to kwas, otrzymuje się krzemionkę żelową.
Krzemionkę pirogeniczną jest wytwarzana przez spalanie lotnego związku krzemu, zwykle silikonowego tetrachlorku Sicl4. Wytrącona krzemionka uzyskuje się z wodnego roztworu krzemianów, do którego dodaje się kwas.
Krzemionka koloidalna jest stabilną dyspersją amorficznych cząstek koloidalnych w wodnym roztworze.
Aplikacje
W kilku aplikacjach
Krzemionka lub sio2 Ma na przykład szeroką gamę funkcji, na przykład jako ścierny, chłonny, antyapelmazante, wypchany, zmętający i faworyzowanie zawieszenia innych substancji, wśród wielu innych sposobów zatrudnienia.
Jest używany na przykład:
-W szkłach, ceramice, opornej, ściernej i rozpuszczalnej produkcji szkła
-Odbarwienie i oczyszczanie olejów i produktów olejowych
-W formie Foundry
-Jako antyapelmazante wszelkiego rodzaju proszków
-Jako antyspumant
-Aby filtrować ciecze, takie jak rozpuszczalniki suchego mycia, woda basenów oraz ścieki miejskie i przemysłowe
-W produkcji izolatorów cieplnych, cegieł ognioodpornych i materiałów opakowania odpornych na ogień i kwasy
-Jako wypełnianie produkcji papierów i kart, aby były bardziej odporne
-Wypełnione obrazami w celu poprawy jego przepływu i koloru
-W materiałach do polerowania metalowego i drewna, ponieważ zapewniają im ścierność
-W analizie chemicznej laboratoria w chromatografii i jako pochłanianie
-Jako antyapelmazante insektycydów i formuł agrochemicznych, aby pomóc w szlifowaniu pestycydalnym i jako nośnik związku aktywnego
-Jako wsparcie katalizatora
-Jako wypełnienie, aby wzmocnić syntetyczną gumę i gumki
Może ci służyć: fale podłużne: cechy, różnice, przykłady-Jako nośnik płynów w żywności zwierzęcej
-W atramentach drukowanych
-Jako wysyłanie i adsorbent, w postaci żelu krzemionkowego
-Jako addytywne w cemencie
-Jako piasek dla zwierząt
-W przypadku izolatorów mikroelektronicznych
-W przełącznikach termoptycznych
 Żel krzemionkowy. Kenpei [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons.
Żel krzemionkowy. Kenpei [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]. Źródło: Wikimedia Commons. W branży spożywczej
Amorficzna krzemionka jest włączana do różnych produktów spożywczych jako wielofunkcyjny bezpośredni składnik w różnych rodzajach żywności. Nie powinno przekraczać 2% gotowej żywności.
Na przykład służy jako antyapelmazante (aby zapobiec przyklejeniu niektórych pokarmów), jako stabilizator w produkcji piwa, jako antyprecipitator, do filtrowania wina, soków lub warzyw owocowych lub warzyw lub warzyw).
 Zespół do filtrowania wina z okrzemkami (Sio2). Fabio Ingroso [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]. Źródło: Wikimedia Commons.
Zespół do filtrowania wina z okrzemkami (Sio2). Fabio Ingroso [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]. Źródło: Wikimedia Commons. Działa jak płyn chłonny w niektórych pokarmach i składnika mikrokapsułek do aromatyzowania olejków.
Ponadto SIO2 Amorficzne jest stosowane przez specjalny proces na powierzchni tworzyw sztucznych artykułów w celu pakowania żywności, działając jako bariera.
W branży farmaceutycznej
Jest dodawany jako środek antyapelmazante, pogrubienie, żelowanie i jako substancja substancji, to znaczy jako asystent kształtowania kilku leków i witamin.
W branży kosmetycznej i opiece osobistej
Jest stosowany w wielu produktach: w proszkach twarzy, cieniach, oczu, szminkach, kolorystyce, schroniskach do makijażu, talkos, proszkach stóp, barwnikach do włosów i wybielacza i wybielacza.
Również w olejach i sole kąpiel.
Również w nocnych kremach nawodnienia, jasność i farba do paznokci.
W zastosowaniach terapeutycznych
Sio2 Jest obecny w szklance bioaktywnym lub biovidrios, którego główną cechą jest to, że mogą reagować chemicznie z otaczającym je środowiskiem biologicznym, tworząc silny i trwały związek z żywą tkanką.
Ten rodzaj materiału służy do tworzenia substytutów kości, takich jak te z twarzy, takie jak „rusztowanie”, w którym rosną komórki kostne. Wykazali dobrą biokompatybilność zarówno z kościami, jak i tkankami miękkimi.
Te biovidrios pozwolą na odzyskanie kości od twarzy dla osób, które straciły je przypadkiem lub chorobą.
Ryzyko
Bardzo cienkie cząsteczki krzemionki można zawiesić w powietrzu i tworzyć proszki niekłasne. Ale ten kurz może podrażniać skórę i oczy. Jego inhalacja powoduje podrażnienie dróg oddechowych.
Ponadto wdychanie pyłu krzemionkowego powoduje długoterminowe uszkodzenie płuc, zwane krzemię.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Dwutlenek krzemu. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Da Silva, m.R. i in. (2017). Techniki zielonych ekstrakcji. Sorbnt na bazie krzemionki. W zrozumieniu chemii analitycznej. Odzyskane z naukowym.com.
- Ylänen, h. (redaktor). (2018). Kieliszki bioaktywne: materiały, właściwości i zastosowania (wydanie drugie). Elsevier. Odzyskane z książek.Google.współ.Iść.
- Windholz, m. i in. (redaktorzy) (1983) The Merck Index. Encyklopedia chemikaliów, drarugów i biologicznych. Wydanie dziesiąte. Merck & Co., Inc.
- Mäkinen, j. I Suni, T. (2015). Grube film wafle soi. W Handbook of Silicon MEMS Materials and Technologies (wydanie drugie). Odzyskane z naukowym.com.
- Sirleto, l. i in. (2010). Przełączniki termooptyczne. Nanokryształy krzemu. Odzyskane z naukowym.com.
- « Struktura fluorku wapnia (CAF2), właściwości, zastosowania
- 275 piropos dla romantycznych i seksownych mężczyzn »

