Struktura fluorku wapnia (CAF2), właściwości, zastosowania

- 1931
- 283
- Marianna Czarnecki
On Fluor wapnia Jest to nieorganiczna substancja stała utworzona przez atom wapnia (CA) i dwa atomy fluorowe (F). Jego formuła chemiczna to CAF2 I jest to krystaliczna biała biała stała.
W naturze znajduje się w rudzie fluorytowej lub fluorowej rozprysku. Istnieje naturalnie w kościach i zębach. Minerał fluorytowy jest głównym źródłem stosowanym do uzyskania innych związków fluorowych.
 CAF Fluork wapnia2 solidny. W: Użytkownik: Walkerma w czerwcu 2005 roku. Źródło: Wikimedia Commons.
CAF Fluork wapnia2 solidny. W: Użytkownik: Walkerma w czerwcu 2005 roku. Źródło: Wikimedia Commons. Ponadto kawa2 Służy do zapobiegania próchnicy w zębach, więc jest dodawany do materiałów używanych przez dentystów do ich wyleczenia. W rzeczywistości fluor wapnia jest również dodawany do wody pitnej (woda, którą można wypić), dzięki czemu populacja przyniesie korzyści podczas spożywania i szczotkowania zębów.
CAF2 Jest stosowany w dużych kryształach w urządzeniach optycznych i kamerach. Jest również stosowany w małych urządzeniach, które służą do wykrycia, jak bardzo osoba została narażona na radioaktywność.
[TOC]
Struktura
CAF Fluork wapnia2 Jest to związek jonowy utworzony przez kation wapnia CA2+ i dwa fluorowe i-. Jednak niektóre źródła informacji wskazują, że ich linki mają pewien charakter kowalencyjny.
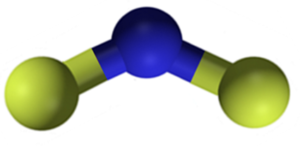 Struktura fluoru wapnia CAF2. Niebieski: wapń; Żółta fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Struktura fluoru wapnia CAF2. Niebieski: wapń; Żółta fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Nomenklatura
Fluor wapnia
Nieruchomości
Stan fizyczny
Kolorowanie stałe do szarawej bieli z sześcienną strukturą krystaliczną.
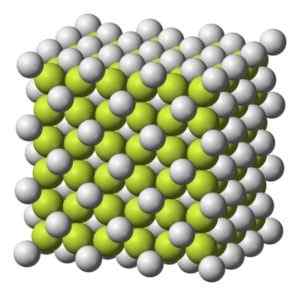 Sześcienna krystaliczna struktura kawy2. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons.
Sześcienna krystaliczna struktura kawy2. Benjah-BMM27 [domena publiczna]. Źródło: Wikimedia Commons. Waga molekularna
78,07 g/mol
Temperatura topnienia
1418 ° C
Punkt wrzenia
2533 ºC
Gęstość
3,18 g/cm3 w 20 ° C.
Współczynnik załamania światła
1 4328
Rozpuszczalność
Jest nierozpuszczalny w wodzie w 20 ° C. Prawie nierozpuszczalne w temperaturze 25 ° C: 0,002 g/100 ml wody. Lekko rozpuszczalny kwas.
Właściwości chemiczne
Jego właściwości utleniające lub redukujące są bardzo słabe, jednak reakcje te mogą wystąpić. Chociaż zwykle w bardzo niewielu przypadkach.
Jest obojętne dla organicznych związków chemicznych i wielu kwasów, w tym kwas fluorhorowy HF. Rozpuszcza się powoli w kwasie azotowym3.
Może ci służyć: Millikan Experiment: Procedura, wyjaśnienie, znaczenieTo nie jest łatwopalne. Nie reaguje szybko z powietrzem lub wodą.
Ze względu na swoje niewielkie powinowactwo do wody, chociaż jest on narażony na wysoki odsetek wilgoci, nie wpływa ona nawet na miesiąc w normalnej temperaturze pokojowej.
W obecności wilgoci ściany ich kryształów są powoli rozpuszczane w temperaturach powyżej 600 ° C. W suchych środowiskach można go używać do około 1000 ° C bez znaczącego dotknięcia.
Obecność w naturze
CAF Fluork wapnia2 Naturalnie występuje w rudzie fluorytowej lub fluorku spostrzeże.
Chociaż kawa2 Czysty jest bezbarwny, fluorytowy minerał jest często zabarwiony obecnością elektronów uwięzionych w „otworach” struktury krystalicznej.
Ten minerał jest bardzo doceniony ze względu na szklistą jasność i różnorodność kolorów (fioletowe, niebieskie, zielone, żółte, bezbarwne, brązowe, różowe, czarne i czerwonawe pomarańczowe). Mówi się, że jest to „najbardziej kolorowy minerał na świecie”.
 Fluoryt kopalni we Francji. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Fluoryt kopalni we Francji. Toulouse Muséum [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons. Fluoryt (niebieskie kryształy) naturalnego Muzeum Mediolanu. Giovanni Dall'orto [CC BY-SA 2.5 It (https: // creativeCommons.ORG/Licencje/BY-SA/2.5/IT/czyn.W)]. Źródło: Wikimedia Commons.
Fluoryt (niebieskie kryształy) naturalnego Muzeum Mediolanu. Giovanni Dall'orto [CC BY-SA 2.5 It (https: // creativeCommons.ORG/Licencje/BY-SA/2.5/IT/czyn.W)]. Źródło: Wikimedia Commons. Fluoryt kopalni w Anglii. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Fluoryt kopalni w Anglii. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Fluoryt kopalni we Francji. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
Fluoryt kopalni we Francji. Didier Descuens [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Źródło: Wikimedia Commons.
 Fluoryt kopalni w USA. Autor: Oliveira Jurema. Źródło: Wikimedia Commons.
Fluoryt kopalni w USA. Autor: Oliveira Jurema. Źródło: Wikimedia Commons. Fluor wapnia występuje również w kościach w ilościach między 0,2 a 0,65%, a także w szkliwie zębów w 0,33-0,59%.
Aplikacje
- W uzyskiwaniu związków fluorkowych
Fluorita CAF2 Jest to podstawowe lub większość źródła fluoru na całym świecie. Jest to surowiec do przygotowania prawie wszystkich związków fluorowych.
Najważniejszym z nich jest kwas fluorhorowy HF, z którego przygotowuje się inne flukowane związki. Jon fluorkowy f- Jest uwalniany z minerału przez reakcję tego ze stężonym kwasem siarkowym H2południowy zachód4:
Może ci służyć: izomeriaCAF2 (stałe) + h2południowy zachód4 (ciecz) → Case4 (stałe) + 2 HF (gaz)
- Pod opieką zębów
CAF Fluork wapnia2 Jest to agent zapobiegania próchnicy. Służy do fluoryzacji wód pijowych (wody, które mogą być piciem) z tym celem.
Ponadto niskie stężenia fluorkowe f- (z rzędu 0,1 części na milion), które są stosowane w pastach zębowych i płynach jamy ustnej, mają głęboki pozytywny wpływ na zapobiegawczą opiekę nad zębami nad próchnicą.
 Fluor wapnia pomaga w zapobieganiu próchnicy. Autor: Annalise Batista. Źródło: Pixabay.
Fluor wapnia pomaga w zapobieganiu próchnicy. Autor: Annalise Batista. Źródło: Pixabay. Nanocząstki CAF2 bardziej efektywny
Chociaż fluorki są stosowane w pastach i płukanie, niskie stężenie wapnia (CA) w ślinie powoduje, że złoża kawy nie tworzą2 w zębach w najskuteczniejszy możliwy sposób.
Dlatego opracowano sposób na uzyskanie kurzu kawy2 jako nanocząstki.
Do tego Rocío używany jest suszarka (z angielskiego Suszarka sprayu) Gdzie dwa rozwiązania (jedno z wodorotlenku wapnia Ca (OH)2 i jeden z fluorku amonu NH4F) Mieszają się podczas rozpylania aparatu z przepływem gorącego powietrza.
Wtedy następuje następująca reakcja:
CA (OH)2 + NH4F → CAF2 (stałe) + NH4Oh
NH4OH Volatilizuje się jako NH3 i H2O i nanocząstki CAF pozostają2.
Mają one wysoką reaktywność i większą rozpuszczalność, co czyni je bardziej skutecznymi w seineralizacji zębów i jako antykorierów.
- W obiektywach dla urządzeń optycznych
Fluor wapnia służy do budowy elementów optycznych, takich jak pryzmaty i spektrofotometry w podczerwieni i światła ultrafioletowe (UV).
Urządzenia te umożliwiają pomiar ilości światła pochłanianego przez materiał, gdy przez niego przechodzi.
CAF2 Jest przezroczysty w tych obszarach widma światła, ma wyjątkowo niski wskaźnik refrakcji i pozwala uzyskać bardziej wydajną rozdzielczość niż NaCl w przedziale 1500-4000 cm-1.
Może ci służyć: paramagnetyzmDzięki jego stabilności chemicznej mogą wspierać niekorzystne warunki, aby elementy optyczne CAF2 Nie są atakowani. Ma również wysoką twardość.
W kamerach
Niektórzy producenci aparatów używają soczewek kawy2 Sztuczny krystalizowany w celu zmniejszenia dyspersji światła i osiągnięcia doskonałej korekty zniekształceń kolorów.
 Niektóre kamery mają soczewki fluorku wapnia CAF2 Aby zmniejszyć zniekształcenie kolorów. Bill Ebbesen [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons.
Niektóre kamery mają soczewki fluorku wapnia CAF2 Aby zmniejszyć zniekształcenie kolorów. Bill Ebbesen [CC o 3.0 (https: // creativeCommons.Org/licencje/według/3.0)]. Źródło: Wikimedia Commons. - W branży metalurgicznej
CAF2 Jest stosowany jako środek założyciel w branży metalurgicznej, ponieważ jest źródłem nierozpuszczalnego wapnia w wodzie, a zatem skutecznie w zastosowaniach wrażliwych na tlen.
Służy do stopienia i przetwarzania żelaza i stali. Opiera się to na fakcie, że ma on temperaturę topnienia podobną do żelaza, a także może rozpuszczać tlenki i metale.
- W detektorach radioaktywności lub niebezpiecznym promieniowaniu
CAF2 Jest to materiał termoluminescencyjny. Oznacza to, że może pochłaniać promieniowanie w elektronach jego krystalicznej struktury, a następnie po podgrzaniu, aby uwolnić go w postaci światła.
To emitowane światło można zmierzyć za pomocą sygnału elektrycznego. Ten sygnał jest proporcjonalny do ilości promieniowania otrzymanego przez materiał. Oznacza, że im większa ilość promieniowania, tym większa ilość światła, które zostanie emitowane później po podgrzaniu.
Dlatego CAF2 Jest używany w SO -Called Osobiste dwametry, które są używane przez osoby narażone na niebezpieczne promieniowanie i chcesz wiedzieć, ile promieniowania otrzymali w okresie czasu.
- Inne zastosowania
- Jest stosowany jako katalizator w reakcjach chemicznych odwodnienia i odwodornienia do syntezy związków organicznych.
- Jest stosowany w elektrodach alkalicznych spawania. Uzyskuje się silniejsze spawanie niż w przypadku elektrod kwasowych. Te elektrody są przydatne w produkcji statków i pojemników na stal wysokociśnieniową.
- Jako suplement pokarmowy w bardzo niskich ilościach (PPM lub części na milion).
 Spawanie człowieka. Elektrody z kawą fluorku wapnia2 Tworzą silniejsze spoiny. William m. Płyta Jr. [Domena publiczna]. Źródło: Wikimedia Commons.
Spawanie człowieka. Elektrody z kawą fluorku wapnia2 Tworzą silniejsze spoiny. William m. Płyta Jr. [Domena publiczna]. Źródło: Wikimedia Commons. Bibliografia
- Pirmradian, m. i Hooshmand, t. (2019). Remineralizacja i zdolności przeciwbakteryjne nanokompozytów dentystycznych na bazie żywicy. Synteza i charakterystyka fluorku wapnia (CAF2). W zastosowaniach materiałów nanokompozytowych w stomatologii. Odzyskane z naukowym.com.
- LUB.S. National Library of Medicine. (2019). Wapń fluorkowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Weman, k. (2012). Spawanie ręczne (MMA) z powlekaniem elektrodami. W Processes Handbook (druga edycja). Odzyskane z naukowym.com.
- Hanning, m. i Hanning, C. (2013). Nanobiomateriały w stomatologii profilaktycznej. Wapń fluorkowy nanosowany. W nanobiomateriałach w stomatologii klinicznej. Odzyskane z naukowym.com.
- Ropp, r.C. (2013). Grupa 17 (H, F, Cl, Br, I) Związki Ziemi alkalicznej. Wapń fluorkowy. W encyklopedii alkalicznych związków Ziemi. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Valkovic, v. (2000). Pomiary radioaktywności. W radioaktywności w środowisku. Detektory Imoluminessent (TLD). Odzyskane z naukowym.com.
- « Struktura Notruro de Boro (BN), właściwości, uzyskiwanie, użycia
- Struktura tlenku krzemu (SiO2), właściwości, stosowanie, uzyskiwanie »

