Ulatnianie się

- 1967
- 438
- Pani Gilbert Stolarczyk
 Gdy woda jest podgrzewana na płycie, aż wystąpi para, wystąpi ulatnianie się. Z licencją
Gdy woda jest podgrzewana na płycie, aż wystąpi para, wystąpi ulatnianie się. Z licencją Co to jest ulatnianie?
ulatnianie się Jest to proces przekształcenia substancji chemicznej w stanie ciecz lub stałego w gazowy lub pary. Inne terminy używane do opisania tego samego procesu to para waporyzacji, destylacja i sublimacja.
Substancję można często oddzielić od innej przez ulotki i może być odzyskane przez kondensację pary.
Substancję można szybciej usiąść, albo podgrzewając ją w celu zwiększenia ciśnienia pary, albo przez parowanie, za pomocą obojętnego strumienia gazu lub pompy próżniowej.
Procedury ogrzewania obejmują uwiecznia wodę, rtęć lub trichlorek arsen.
Czasami reakcje chemiczne są stosowane do wytwarzania lotnych produktów, jak w uwalnianiu dwutlenku węgla z węglanów, amoniaku w metodzie Kjeldahl do oznaczania azotu i dwutlenku siarki w oznaczaniu siarki stalowej.
Metody ulotki są ogólnie charakteryzowane dużą prostotą i łatwością działania, z wyjątkiem sytuacji, gdy potrzebne są wysoce odporne na odporność na korozję lub materiały.
Vapor Ciśnienie
Wiedząc, że temperatura wrzenia wody wynosi 100 ° C, należy zapytać, dlaczego odparowuje wodę deszczową. Jeśli jest w 100 ° C, powinien dać nam ciepło.
Warto również zapytać, co charakterystyczny aromat nadaje alkoholu, octu, drewna lub plastiku.
Osoba odpowiedzialna za to wszystko jest właściwością znaną jako ciśnienie pary, czyli ciśnienie wywierane przez parę w równowadze z fazą stałą lub ciekłą tej samej substancji. Ponadto ciśnienie częściowe substancji w atmosferze na stałym lub ciekłym.
Ciśnienie pary jest miarą tendencji materiału do zmiany na stan gazowy lub pary, to znaczy miara zmienności substancji.
Może ci służyć: disiarczde węglowe (CS2): struktura, właściwości, zastosowania, ryzykoWraz ze wzrostem ciśnienia pary, im większa pojemność cieczy lub stała do odparowania, a tym samym jest bardziej lotna.
Ciśnienie pary wzrośnie wraz z temperaturą. Temperatura, przy której ciśnienie pary na powierzchni cieczy jest równe ciśowi wywieranemu przez środowisko, nazywa się temperaturą wrzenia cieczy.
Ciśnienie pary będzie zależeć od rozpuszczonego rozpuszczonego w roztworze (jest to właściwość kajgwita). Na powierzchni roztworu (interfejs powietrza) najbardziej powierzchowne cząsteczki mają tendencję do odparowania, wymiany między fazami i generując ciśnienie pary.
Obecność substancji rozpuszczonej zmniejsza liczbę cząsteczek rozpuszczalnika na interfejsie, zmniejszając ciśnienie pary.
Zmianę ciśnienia pary można obliczyć za pomocą prawa Raault dla substancji rozpuszczonych nielotnych, które są podane przez:
(1)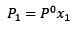 Gdzie p1 jest ciśnieniem pary po dodaniu substancji rozpuszczonej, x1 jest frakcją molową wspomnianej substancji rozpuszczonej, a p ° jest ciśnieniem pary czystego rozpuszczalnika.
Gdzie p1 jest ciśnieniem pary po dodaniu substancji rozpuszczonej, x1 jest frakcją molową wspomnianej substancji rozpuszczonej, a p ° jest ciśnieniem pary czystego rozpuszczalnika.
Jeśli suma frakcji molowych substancji rozpuszczonej i rozpuszczalnika jest równa 1, mamy:
(2)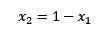
Gdzie x2 jest frakcją molową rozpuszczalnika. Jeśli pomnożymy obie strony równania przez p °, pozostaje on:
(3)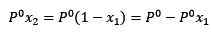
Zastąpienie (1) w (3) pozostaje:
(4)
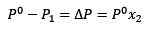
Jest to zmienność ciśnienia pary, gdy rozpuszcza się substancja rozpuszczona.
Analiza grawimetryczna
Analiza grawimetryczna to klasa technik laboratoryjnych stosowanych do określenia masy lub stężenia substancji poprzez pomiar zmiany masy.
Chemik, który próbujemy kwantyfikować, jest czasem nazywany analitem. Możemy użyć analizy grawimetrycznej, aby odpowiedzieć na pytania takie jak:
Może ci służyć: metalowe minerały- Jakie jest stężenie analitu w roztworze?
- Jak czysta jest nasza próbka? Próbka tutaj może być stałą lub w roztworze.
Istnieją dwa popularne rodzaje analizy grawimetrycznej. Oba obejmują zmianę fazy analitu w celu oddzielenia jej od reszty mieszanki, co powoduje zmianę ciasta.
Jedną z tych metod jest grawimetria opadów, ale ta, która naprawdę nas interesuje, jest grawimetria ulotki.
Grawimetria ulotki opiera się na próbce termicznej lub chemicznej i mierzy wynikową zmianę masy.
Alternatywnie możemy złapać i zważyć niestabilny produkt rozkładu. Ponieważ uwalnianie gatunku lotnego jest istotną częścią tych metod, wspólnie klasyfikujemy je jako metody analizy grawimetrycznej.
Problemy z analizą grawimetryczną to po prostu problemy ze stechiometrią z kilkoma dodatkowymi krokami.
Aby wykonać dowolne obliczenia stechiometryczne, potrzebujemy współczynników zrównoważonego równania chemicznego.
Na przykład, jeśli próbka zawiera zanieczyszczenia baru dihydred (BACL2● h₂o), możesz uzyskać ilość zanieczyszczeń ogrzewających próbkę do odparowania wody.
Różnica masy między pierwotną próbką a podgrzewaną próbką da nam, w Gramach, ilość wody zawartej w chlorku baru.
Z prostymi obliczeniami stechiometrycznymi uzyskano ilość zanieczyszczeń próbki.
Frakcjonowa destylacja
Frakcjonalna destylacja to proces, w którym składniki mieszaniny ciekłej są podzielone na różne części (zwane frakcjami) zgodnie z różnymi temperaturami wrzenia.
Różnica zmienności związków mieszaniny odgrywa podstawową rolę w jej oddzieleniu.
Może ci służyć: reguła oktetuDestylacja ułamkowa służy do oczyszczania chemikaliów, a także do oddzielania mieszanin i uzyskania ich składników. Jest stosowany jako technika laboratoryjna i w branży, w której proces ma ogromne znaczenie komercyjne.
Pary wrzącego roztworu są przekazywane wzdłuż wysokiej kolumny, zwaną kolumną podrewizyjną.
Kolumna jest pakowana plastikowymi lub szklanymi perłami w celu poprawy separacji, zapewniając więcej powierzchni do kondensacji i parowania.
Temperatura kolumny stopniowo maleje wzdłuż jej długości. Komponenty o wyższej temperaturze wrzenia są skondensowane w kolumnie i wracają do roztworu.
Dolne elementy punktów wrzenia (bardziej niestabilne) przechodzą przez kolumnę i są zbierane u góry.
Teoretycznie posiadanie większej liczby pereł lub płyt poprawia separacja, ale dodanie płyt zwiększa również czas i energię wymaganą do ukończenia destylacji.
Przykłady ulatniania
- Blok suchego lodu w kontakcie z pęknięciem powietrza. Powietrze rozpoczyna proces ulatniania, a lód odparowuje: przechodzi ze stanu stałego do sody.
- Gdy woda lub inna substancja jest gotowana: ciepło wytwarza parę, a zatem woda przechodzi ze stanu ciekłego do gazu.
- Pigułki naftainy, które stopniowo degradują i przechodzą ze stanu stałego do sody.
- Gdy siarka stała jest poddawana wysokim temperaturom, staje się toksyczne. Oznacza to, że przechodzi od solidnego do gazu.
- Pigułki aromatyczne: mają taki sam proces jak pigułki naftainy, stopniowo degradują i stają się gazem, zapachem i nieszkodliwym.
Bibliografia
- Definicja ciśnienia para. Wyzdrowiał z Thoughco.com.
- Ciśnienie pary. Odzyskane z Britannica.com.

