Struktura miedzi, właściwości, używa

- 651
- 89
- Pani Waleria Marek
On Siar miedziany Jest to rodzina związków nieorganicznych, której ogólnym wzorem chemicznym jest CuXSI. Tak X Jest większy niż I Oznacza to, że ten siarczek jest bogatszy w miedź niż w siarce; A jeśli wręcz przeciwnie, X Jest mniejszy niż I, Wówczas siarczka jest bogatsza w siarkę niż w miedzi.
W naturze liczne minerały reprezentujące naturalne źródła tego związku dominują. Prawie wszystkie z nich są bogatsze w miedzi niż w siarce, a ich skład jest wyrażany i uproszczony przez formułę zXS; Tutaj X Możesz nawet przyjąć wartości ułamkowe, wskazujące na stechiometryczne ciałę stałą (Cu1.75S, na przykład).
 Próbka minerału Covellita, jedno z wielu naturalnych źródeł siarczku miedzi. Źródło: James St. John [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)]
Próbka minerału Covellita, jedno z wielu naturalnych źródeł siarczku miedzi. Źródło: James St. John [CC przez 2.0 (https: // creativeCommons.Org/licencje/według/2.0)] Chociaż w stanie elementarnym siarka jest żółta, jej związki pochodne wyglądają na ciemne kolory; Takie występuje również w przypadku siarczku miedzi. Jednak minerał Covelita (obraz doskonały), który składa się głównie z CUS, wykazuje brokat metalowy i niebieskawo opalizującą.
Można je przygotować z różnych źródeł miedzi i siarki, stosując różne techniki i zmieniając parametry syntezy. W ten sposób możesz uzyskać nanocząstki CUS z interesującymi morfologią.
[TOC]
Struktura siarczku miedzi
Spinki do mankietów
Ten związek ma wygląd bycia krystalicznym, więc możesz od razu pomyśleć, że składa się z jonów Cu+ (Monowalentna miedź), cu2+ (Dyspoliastowa miedź), s2- E, a nawet s2- i s22- (aniony disulfurowe), które oddziałują przez siły elektrostatyczne lub wiązanie jonowe.
Istnieje jednak niewielki charakter kowalencyjny między Cu i S, a zatem nie można wykluczyć łącza Cu-S. Z tego rozumowania struktura krystaliczna CUS (i ze wszystkich jego pochodnych ciał stałych) zaczyna różnić się od tych znalezionych lub scharakteryzowanych dla innych związków jonowych lub kowalencyjnych.
Innymi słowy, nie można mówić o czystych jonach, ale że pośród jego atrakcji (kation-anion) istnieje niewielkie nakładanie się zewnętrznych orbitali (udostępnianie elektronów).
Koordynacje w Covelita
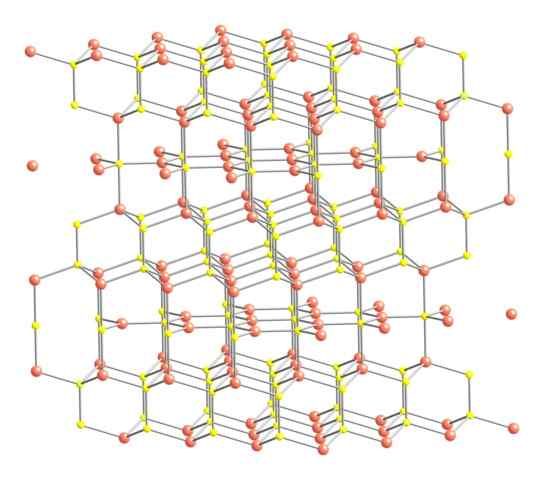 Krystaliczna struktura Covellita. Źródło: Benjah-BMM27 [domena publiczna].
Krystaliczna struktura Covellita. Źródło: Benjah-BMM27 [domena publiczna]. Powiedziawszy powyżej, krystaliczna struktura kovelitu jest pokazana na obrazie. Składa się z kryształów sześciokątnych (zdefiniowanych przez parametry ich komórek jednostkowych), w których jony wiążą się i prowadzą w różnych koornacjach; Są to z różnorodną liczbą pobliskich sąsiadów.
Może ci służyć: rodzaj linku 02Na zdjęciu jony miedzi są reprezentowane z różowymi kulami, a siarka z żółtymi kulami.
Skupiając uwagę najpierw na różowych sferach, zostanie zauważone, że niektóre są otoczone trzema żółtymi kulami (trygonalna płaska koordynacja), a inne dla czterech (koordynacja czworościenna).
Pierwszy rodzaj miedzi, trygonalny, można zidentyfikować w płaszczyznach prostopadłych do sześciokątnych twarzy, które dają wobec czytelnika, w których z kolei są drugim rodzajem węgla, tetraedrycznego.
Uczęszczając teraz do żółtych kul, niektóre mają pięć różowych kulek (trygonalna koordynacja bipiramidy) i kolejne trzy i żółtą kulę (ponownie koordynacja czworościenna); W tym ostatnim jest to przed anionem disiarczkowym, który można wizualizować i w obrębie tej samej struktury kovelitu:
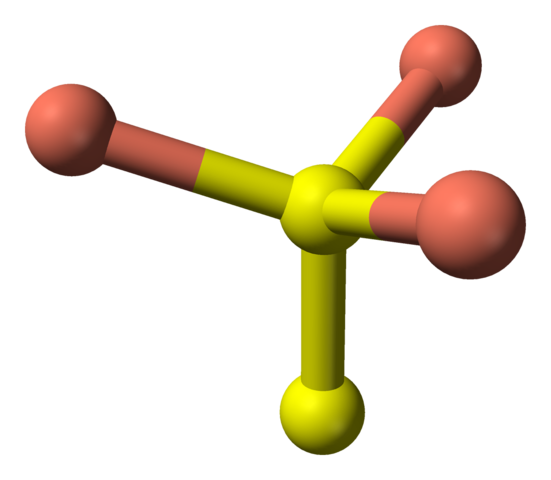 Czworościenna koordynacja anionu disiarczkowego w Covellita. Źródło: Benjah-BMM27 [domena publiczna].
Czworościenna koordynacja anionu disiarczkowego w Covellita. Źródło: Benjah-BMM27 [domena publiczna]. Alternatywna formuła
Istnieją wtedy jony cu2+, Cu+, S2- i s22-. Jednak badania przeprowadzone za pomocą spektroskopii fotoelektronicznej XPS (XPS) wskazują, że cała miedź jest jak kationów cu+; I dlatego początkowy wzór CUS jest wyrażany „lepiej” jako (cu+)3(S2−) (S2)-.
Zauważ, że związek Cu: S dla poprzedniej formuły nadal wynosi 1, a także obciążenia są anulowane.
Inne kryształy
Sulfid miedzi może przyjmować kryształy ortorombowe, jak w polimorfilu, γ-CU2S, kalcitita; sześcienne, jak w innym polimorfie kalcytu, α-Cu2S; Tetragonalny, w minerałach anilita, cu1.75S; monokliniczny w Djurleita, Cu1.96S, między innymi.
Dla każdego zdefiniowanego szkła jest minerał, a z kolei każdy minerał ma swoje własne cechy i właściwości.
Nieruchomości
Ogólny
Właściwości siarczku miedzi podlegają relacji Cu: s ich ciał stałych. Na przykład te, które przedstawiają aniony22- Mają struktury sześciokątne i mogą być półprzewodnikami lub metalowymi przewodami.
Może ci służyć: fosforan potasu (K3PO4): Struktura, właściwości, zastosowaniaJeśli z drugiej strony zawartość siarki składa się z anionów2-, Siarczki zachowują się jak półprzewodniki, a także przedstawiają przewodnictwo jonowe w wysokich temperaturach. Jest tak, ponieważ ich jony zaczynają wibrować i poruszać się do kryształów, przenosząc w ten sposób ładunki elektryczne.
Optycznie, chociaż zależy to również od składu miedzi i siarki, siarki mogą, ale nie muszą wchłaniać promieniowania w obszarze w podczerwieni widma elektromagnetycznego. Te właściwości optyczne i elektryczne wytwarzają potencjalne materiały do wdrożenia w różnych urządzeniach.
Kolejne zmienne do rozważenia, oprócz relacji Cu: S, to wielkość kryształów. Nie tylko chodzi o więcej „siarki” lub „miedzianych” siarczków miedzi, ale wymiary ich kryształów nadają niedokładny wpływ na ich właściwości; Zatem naukowcy chętnie się uczą i szukają zastosowań do nanocząstek CuXSI.
Covelita
Każdy minerał lub siarczk miedzi ma unikalne właściwości. Jednak spośród wszystkich Covelita jest najciekawsza ze strukturalnego i estetycznego punktu widzenia (ze względu na jej opalizowanie i niebieskie tony). Dlatego niektóre z jego właściwości są wymienione poniżej.
Masa cząsteczkowa
95 611 g/mol.
Gęstość
4,76 g/ml.
Temperatura topnienia
500ºC; Ale to się załamuje.
Rozpuszczalność wody
3,3 · 10-5 G/100 ml w 18ºC.
Aplikacje
Nanocząstki w medycynie
Nie tylko zmienia rozmiar cząstek, aż zasięg. Zatem siarczk miedzi może tworzyć nanosfery, pręty, płytki, cienkie filmy, klatki, kable lub rurki.
Te cząstki i ich atrakcyjne morfologie nabierają indywidualnych zastosowań w różnych ziemiach medycyny.
Na przykład nanoulas lub puste kule mogą służyć jako transportery narkotykowe w ciele. Zastosowano nanosfer, wspierane przez szkło węglowe i nanorurki węglowe, aby służyć jako detektory glukozy; a także ich agregaty są wrażliwe na wykrywania biomolekuł, takie jak DNA.
Może ci służyć: 6 naturalnych wskaźników pH i ich cechyNanorurki CUS przekraczają nanosferas w wykrywaniu glukozy. Oprócz tych biomolekuł, immunosensory zostały zaprojektowane z cienkich warstw CUS i pewnych wsporników detekcji patogennej.
Nanokryształy i amorficzne agregaty CU mogą nawet powodować apoptozę komórek rakowych, nie powodując uszkodzenia zdrowych komórek.
Nanoscience
W przedniej części podsekcji powiedziano, że ich nanocząstki były częścią biosensorów i elektrod. Oprócz takich zastosowań naukowcy i technicy skorzystali również z ich właściwości do projektowania ogniw słonecznych, kondensatorów, akumulatorów litowych i katalizatorów dla bardzo specyficznych reakcji organicznych; Niezbędne elementy w nanonauki.
Warto również wspomnieć, że gdy są one poparte węglem aktywnym, zestaw NPCUS-CA (CA: węgiel aktywowany i NP: Nanocząstki) okazał się służy jako zmywacza szkodliwych barwników dla ludzi, a zatem funkcjonuje jako oczyszczacza z Źródła ze źródeł wody pochłaniających niechciane cząsteczki.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Siar miedziany. Źródło: w:.Wikipedia.org
- Ivan Grozdanov i Methodija Najdoski. (1995). Właściwości optyczne i elektryczne warstw siarczku miedzi o zmiennej składu. Journal of Solid State Chemistry Tom 114, wydanie 2, 1 lutego 1995 r., Strony 469-475. doi.Org/10.1006/JSSC.1995.1070
- National Center for Biotechnology Information. (2019). Siarczek miedzi (CUS). Baza danych Pubchem. CID = 14831. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Peter a. Ajibade i Nandipha L. Botha. (2017). Synteza, właściwości optyczne i strukturalne
- nanokryształów siarczku miedziowego z prekursorów pojedynczych cząsteczek. Department of Chemistry, University of Fort Hare, Private Bag X1314, Alice 5700, Republika Południowej Afryki. Nanomateriały, 7, 32.
- Współpraca: autorzy i redaktorzy Volumes III/17E-17F-41C (S.F.). Siarczki miedzi (Cu2S, Cu (2-x) S) Struktura krystaliczna, parametry Latice. W: Madelung lub., Rössler u., Schulz m. (Eds) Elementy nieokarżonkowe i związki binarne I. Landolt-Börnstein-Group III Materia skondensowana (dane numeryczne i relacje funkcjonalne w nauce i technologii), vol 41c. Springer, Berlin, Heidelberg.
- Momtan, f., Vafaei, a., Ghaedi, m. i in. Koreański J. Chem. Eng. (2018). Zastosowanie nanocząstek siarczku miedzi obciążonego węglem aktywnym do jednoczesnej adsorpcji barwników terminowych: metodologia powierzchni odpowiedzi. 35: 1108. doi.Org/10.1007/S11814-018-0012-1
- Goel, s., Chen, f., & Cai, w. (2014). Synteza i zastosowanie biomedyczne nanocząstek siarczku miedzi: od czujników do terranostyków. Mały (Weinheim an der bergstrasse, Niemcy), 10 (4), 631-645. Doi: 10.1002/SMLL.201301174

