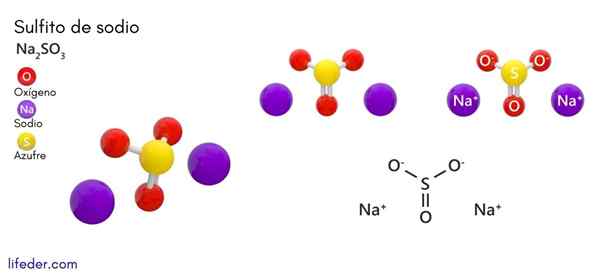
Sulfit sodu (Na2SO3)
- 2094
- 345
- Pani Waleria Marek
Co to jest siarcze sodu?
On siarczyn sodu lub siarczan sodu, którego wzór chemiczny to Na2południowy zachód3, Jest to rozpuszczalna sól sodu, która jest uzyskiwana jako produkt reakcji kwasu siarkowego (lub tlenku siarki (iv)) z wodorotlenkiem sodu.
W latach 1650–1660 Glauber zaczął wytwarzać siarczt sodu ze wspólnej soli (NaCl) i skoncentrowanego kwasu siarkowego. Proces ten jest uważany za początek przemysłu chemicznego.
Proces siarczkowy wytwarza miazgę drewnianą, która jest obserwowana jako prawie czysty błonnik celulozowy za pomocą kilku soli kwasu siarkowego do ekstrakcji ligniny drewnianych odłamków.
Zatem siarki mają wiele zastosowań różnych typów, w tym w branży spożywczej jako addytyw. Wśród jego najbardziej odpowiednich funkcji, jego enzymatyczne i nieenzymatyczne brązowanie, kontrola i hamowanie wzrostu drobnoustrojów, zapobieganie oksydacyjnym ukorzenianiu i modyfikacji właściwości reologicznych żywności.
Przygotowanie sodu w siarce
Zasadniczo w skali laboratoryjnej siarczek sodu występuje w reakcji roztworu wodorotlenku sodu z gazem dwutlenku siarki (2NAOH + SO2 → na2południowy zachód3 + H2ALBO).
Następnie ewolucja SO2 Dodając kilka kropli skoncentrowanego kwasu chlorowodorowego, wskazuje to, czy prawie brakuje wodorotlenku sodu, zamieniony w wodny siarczan sodu (Na2południowy zachód3 + 2HCl → 2NACL + SO2 + H2ALBO).
Z drugiej strony ten związek chemiczny uzyskuje się przemysłowo przez reakcję dwutlenku siarczku za pomocą roztworu węglanu sodu.
Może ci służyć: notacja spektralnaPoczątkowa kombinacja generuje bisulfit sodu (nahso3), Że reagując z wodorotlenkiem sodu lub karmą sodu, jest on przekształcany w siarczan sodu. Reakcje te można podsumować w reakcji globalnej2 + Na2WSPÓŁ3 → na2południowy zachód3 + WSPÓŁ2.
Struktura chemiczna
Wszystkie kształty siarczku sodu charakteryzują się jako białe, krystaliczne i higroskopowe stałe, które mają zdolność do łatwego przyciągania i zatrzymywania cząsteczek wody otaczającego środowiska, które zwykle są w temperaturze pokojowej w pokojowej temperaturze pokojowej.
Rodzaj struktury krystalicznej jest powiązany z obecnością wody w związku. Sulfit anhydium sodu przedstawia strukturę ortorombową lub sześciokątną, a w przypadku obecności cząsteczek wody w związku zmienia jego strukturę (na przykład heptahydrate sodowy siarak sodu ma strukturę monoklinową).
Nieruchomości
Gatunek ten ma pewne właściwości fizyczne i chemiczne, które odróżniają go od innych soli, które opisano poniżej:
Właściwości chemiczne
Jako nasycony roztwór wodny, ta substancja ma przybliżone pH 9. Ponadto roztwory narażone na powietrze ostatecznie utleniają siarczan sodu.
Z drugiej strony, jeśli siarczt sodu roztworu wodnego może krystalizować w temperaturze pokojowej lub niższej, robi to jako hepthydrat. Kryształy heptahydraty wykina w gorącym i suchym powietrzu, również utleniają się w powietrzu, tworząc siarczan.
W tym sensie forma anodry jest znacznie bardziej stabilna w stosunku do utleniania powietrza. Sulfit jest niezgodny z kwasami, silnymi utleniaczami i wysokimi temperaturami. Jest również nierozpuszczalny w amoniaku i chloru.
Może ci służyć: alkohol izopropylowyWłaściwości fizyczne
Sulfit anhydium sodu ma masę molową 126,43 g/mol, gęstość 2633 g/cm3, Punkt fuzji 33,4 ° C (92,1 ° F lub 306,5 K), temperatura wrzenia 1 429 ° C (2604 ° F lub 1702 K) i nie jest łatwopalna. Również rozpuszczalność (mierzona w temperaturze 20 ° C) wynosi 13,9 g/100 ml.
Używa/aplikacje
Ze względu na swoje właściwości reaktywne siarczan sodu jest bardzo wszechstronny i obecnie wykorzystuje szeroko rodzaje branż.
- Jest szeroko stosowany w uzdatnianiu wody i eliminacji rozpuszczonego tlenu w kotłach wodnych.
- Posiada również zastosowania w branży papierowej (pułapka półki).
- W fotografii jest stosowany w produkcji odkrywania.
- W odpowiednim stopniu jest stosowany w konserwacji żywności i przeciwutleniaczy.
- W branży tekstylnej jest używany w praniu i procesach antykloro.
- Jest również używany jako środek redukujący.
- Ponadto jest stosowany w wtórnym odzyskiwaniu studni olejowych.
- Jest nawet stosowany w produkcji związków organicznych, barwników, atramentów, lepkiego rayona i gumów.
- Jest stosowany w produkcji wielu chemikaliów, w tym siarczanu potasu, siarczku sodu, krzemianu sodu, hiposulfitu sodu i siarczanu aluminium sodu.
Ryzyko
Wpływ narażenia na związek
Przedłużone lub powtarzające się narażenie na tę substancję może powodować zapalenie skóry i reakcje wrażliwości. Ekspozycja w wrażliwość siarczkową, astmatyczna i atopowa.
Podobnie, rozkład kwasu siarczku sodu może uwalniać toksyczny i niebezpieczny dym tlenków siarki, w tym dwutlenku siarki, który może powodować trwałe pogorszenie płuc z powodu przewlekłego i ostrego narażenia.
Może ci służyć: Ididio 192Podobnie ostre zatrucie przez dwutlenek siarki jest rzadkie, ponieważ gaz jest łatwo wykryty. Jest tak irytujący, że kontaktu nie można tolerować.
Wśród objawów kaszel, plotki, kichanie, łzawienie i trudności z oddychaniem. Pracownicy o wysokim nieuniknionym narażeniu mogą ponieść ważne i prawdopodobnie śmiertelne uszkodzenie płuc.
Ekotoksyczność
Sulfit sodu jest roztworem niehałkowym, który jest powszechnie stosowany jako resztkowy czynnik upadku wody. Wysokie stężenia przyczyniają się do dużego zapotrzebowania na tlen chemiczny w środowiskach wodnych.
Konsumpcja żywności z konserwantami
Jednym z dodatków, które mogą powodować problemy u wrażliwych osób, jest grupa znana jako środki siarcze, które obejmują kilka dodatków nieorganicznych siarczkowych (E220-228), w tym siarczan sodu (więc2).
U osób nadwrażliwych lub astmatycznych spożywanie żywności z siarczanami lub wdychanie dwutlenku siarki, może być toksyczne.
Związki te są odpowiedzialne za ograniczenie oskrzeli, które przekłada się na trudność oddychania. Jedynym zabiegiem tej nadmiernej reakcji jest unikanie jedzenia i napojów zawierających siarki.