Struktura dehydrogenazy succynato, funkcja, regulacja, choroby
- 1014
- 154
- Prokul Woliński
SDehydrogenaza uccinato (SDH), Znany również jako kompleks II łańcucha transportu elektronów, jest to mitochondrialny kompleks białkowy z aktywnością enzymatyczną, który działa zarówno w cyklu Krebsa, jak i w łańcuchu przenośnika elektronów (oddychanie komórkowe).
Jest to enzym obecny we wszystkich komórkach tlenowych. W eukariotach jest to kompleks ściśle związany z wewnętrzną błoną mitochondrialną, podczas gdy w prokariotach występuje w błonie plazmatycznej.
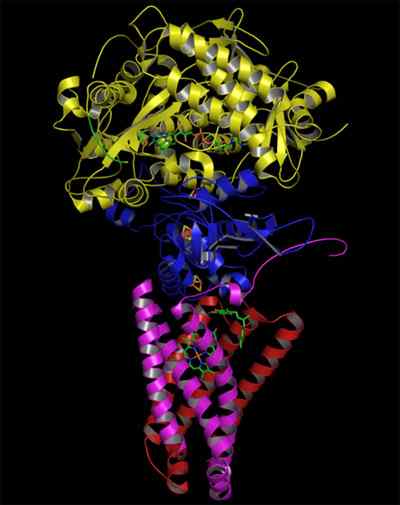
 Ogólny schemat dehydrogenazy bursztynianowej mitochondrialnej (źródło: ja, oparte na wektoryzacji Fvasconcellos. / Domena publiczna, przez wikimedia Commons)
Ogólny schemat dehydrogenazy bursztynianowej mitochondrialnej (źródło: ja, oparte na wektoryzacji Fvasconcellos. / Domena publiczna, przez wikimedia Commons) Złożona dehydrogenaza bursztyniana, odkryta około 1910 r. I oczyszczona po raz pierwszy w 1954 r. Przez Singera i Kearneya, została szeroko zbadana z kilku powodów:
- Działa zarówno w cyklu Krebsa (cykl kwasu cytrynowego lub cykl kwasu trikarboksylowego), jak i w łańcuchu transportu elektronów (katalizuje utlenianie bursztynianu do fumaranu)
- Jego aktywność jest regulowana przez różne aktywatory i inhibitory oraz
- Jest to kompleks związany z: żelazo nie jest powiązane z grupą hemo, siarką krainami i dyukleotydami Flavina adenina (FAD)
Jest kodowany przez genom jądrowy i udowodniono, że mutacje w czterech genach, które kodyfikują każdą z jego podjednostek (A, B, C i D), powodują różne zdjęcia kliniczne, to znaczy mogą być dość ujemne od punktu widoku fizycznej integralności ludzi.
[TOC]
Struktura
Złożona dehydrogenaza enzymatyczna jest tworzona przez cztery podjednostki (heterotarámero) kodowane przez genom jądrowy, więc jest to jedyny kompleks fosforylacji oksydacyjnej w łańcuchu przenośników elektronów, który nie ma podjednostki kodowanej przez genom mitochondrialny genom mitochondrialny.
Ponadto ten kompleks jest jedynym, który nie pompuje protonów przez wewnętrzną błonę mitochondrialną podczas jego katalitycznego działania.
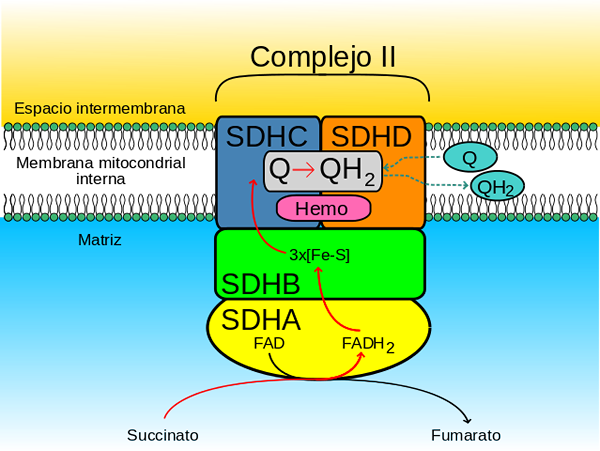
Według badań opartych na kompleksie enzymatycznym komórek serca świńskiej, złożona dehydrogenaza bursztynianowa składa się z:
- A "głowa" Hydrofilowy który rozciąga się od wewnętrznej błony mitochondrialnej do macierzy mitochondrialnej i
- A "linia" Hydrofobowy który jest osadzony w wewnętrznej błonie mitochondrialnej i ma mały segment, który jest rzutowany w kierunku rozpuszczalnej przestrzeni międzybłonowej mitochondriów
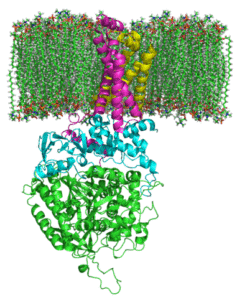 Struktura złożonej dehydrogenazy bursztyniowej (źródło: Zephyris w języku angielskim Wikipedia/CC BY-SA (http: // creativeCommons.Org/licencje/by-sa/3.0/) Via Wikimedia Commons)
Struktura złożonej dehydrogenazy bursztyniowej (źródło: Zephyris w języku angielskim Wikipedia/CC BY-SA (http: // creativeCommons.Org/licencje/by-sa/3.0/) Via Wikimedia Commons) Hydrofilowa struktura części
Hydrofilowa głowa składa się z SDHA (70 kDa) i SDHB (27 kDa) (SDH1 i SDH2 w drożdżach), a to obejmuje katalityczne centrum złożonego złożonego.
Podjednostki SDHA i SDHB zawierają kofaktory redoks uczestniczących w przenoszeniu elektronów do ubichinonu (coenzym Q10, cząsteczka, która transportuje elektrony między kompleksami oddechowymi I, II i III).
Podjednostka SDHA ma FAD kofaktor (koenzym, który uczestniczy w reakcjach ograniczania tlenku) wraz z jego strukturą, tylko w miejscu połączenia dla bursztynianu (główny substrat enzymu).
Podjednostka SDHB ma 3 ośrodki cukru żelaza (FE-S), które pośredniczą w przenoszeniu elektronów do ubichinonu. Jeden z centrów, 2fe-2s, znajduje się w pobliżu miejsca moda podjednostki SDHA, a pozostałe (4fe-4s i 3fe-4s) sąsiadują z pierwszym.
Może ci służyć: filogenezaNależy zauważyć, że badania strukturalne wskazują, że podjednostka SDHB tworzy interfejs między hydrofilową domeną katalityczną a domeną „kotwicy” do błony (hydrofobowej) złożonego.
Hydrofobowa struktura porcji
Domena błonowa kompleksu, jak stwierdzono, składa się z SDHC (15 kDa) i SDHD (12-13 kDa) (SDH3 i SDH4 w drożdżach), które są utworzonymi kompleksowymi białkami błonowymi, każde, przez 3 transmembranowe spustę.
Ta domena zawiera część hemo B połączone w interfejsie między podjednostkami SDHC i SDHD, gdzie każdy z dwóch ligandów histydyny, który utrzymuje je razem.
W tym enzymie wykryto dwa miejsca związkowe dla Ubiquinona: jeden z wielkich powinowactwa i jeden o niskim powinowactwie.
Witryna o wysokim powinowactwie, znana jako QP (P proksymalne) Jest twarzą do matrycy mitochondrialnej i jest tworzona przez specyficzne reszty aminokwasowe zlokalizowane w podjednostkach SDHB, SDHC i SDHD.
Witryna o niskim powinowactwie, również nazywana Qd (D dystalne) Jest to w części wewnętrznej błony mitochondrialnej, w której kompleks jest wkładany, bliżej przestrzeni międzybłonowej, to znaczy dalej od macierzy organelle.
Razem całkowity kompleks ma masę cząsteczkową zbliżoną do 200 kDa i ustalono, że ma stosunek 4.2-5.0 Nanomole Flawin na miligram białka i 2-4 g żelaza dla każdego mol flawiny.
Funkcjonować
Enzymatyczna dehydrogenaza kompleksu bursztynianu wypełnia ważną funkcję w mitochondriach, ponieważ nie tylko uczestniczy w cyklu Krebsa (gdzie uczestniczy w degradacji acetylo -CoA), ale także części łańcucha oddechowego, fundamentalnego dla produkcji energii ATP w kształcie ATP.
Innymi słowy, jest to kluczowy enzym dla metabolizmu pośredniego i produkcji aerobowej ATP.
- Jest odpowiedzialny za utlenianie bursztynianu do fumaranu w cyklu kwasu cytrynowego
- Zasila kompleks III łańcucha przenośnika elektronów z elektronami pochodzącymi z utleniania bursztynianu, co pomaga zmniejszyć tlen i tworzyć wodę
- Transport elektronów generuje gradient elektrochemiczny przez wewnętrzną błonę mitochondrialną, która sprzyja syntezy ATP
Alternatywnie można zastosować elektrony w celu zmniejszenia cząsteczek z „puli” ubikinonas, wytwarzając niezbędne redukcje w celu zmniejszenia anionów nadtlenkowych pochodzących z tego samego łańcucha oddechowego lub pochodzącego ze źródeł egzogennych.
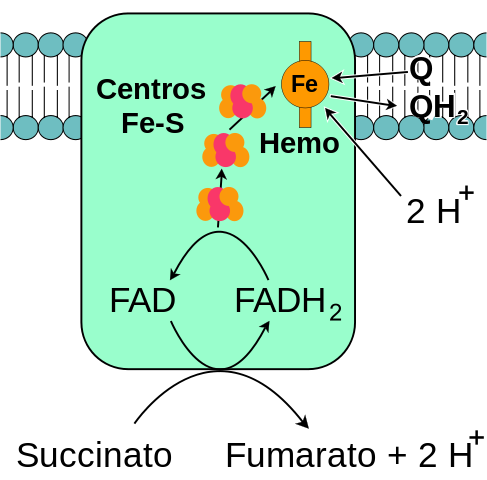
 Kompleks bursztynianu degidrogenasa (Źródło: Johnhfst / Public Domena, Via Wikimedia Commons)
Kompleks bursztynianu degidrogenasa (Źródło: Johnhfst / Public Domena, Via Wikimedia Commons) Jak to działa?
Podjednostka A kompleksu (która jest kowalencyjnie powiązana z koenzymem FAD) łączy substraty, fumaran i bursztynian, a także jego regulatory fizjologiczne, oksolacetan (konkurencyjny inhibitor) i ATP) i ATP).
ATP wypiera zjednoczenie między szczawikiem a kompleksem SDH, a następnie elektrony, które są „przeszłe” od bursztynianu do podjednostki SDHA, są przenoszone do grup żelaza i atomów siarki obecnych w podjednostce SDHB za pomocą fadu kenzymu.
Może ci służyć: miozyna: Charakterystyka, struktura, typy i funkcjaZ podjednostki B elektrony te docierają do miejsc hemo B podjednostek SDHC i SDHD, skąd są „dostarczane” do koenzymów Quinonas przez ich miejsca związkowe do Quinonas.
Przepływ elektroniczny z bursztynianu przez te transportery, a nawet ostateczny akceptor, który jest tlenem, jest połączony z syntezą 1.5 cząsteczek ATP dla każdego momentu elektronicznego poprzez fosforylację łańcucha oddechowego.
Wady Inzima
Doniesiono, że mutacje w genie, że kodowanie podjednostki A złożonej dehydrogenazy bursztynianowej mogą powodować encefalopatie w dzieciństwie, tymczasem mutacje w genach, które kodują podjednostki B, C i D, były związane z tworzeniem guzów.
Rozporządzenie
Aktywność złożonej dehydrogenazy bursztynianowej można regulować przez modyfikacje po translacyjnej, takie jak Fosforylacja i acetylacja, Chociaż może wystąpić również aktywne hamowanie miejsca.
Acetylacja niektórych odpadów lizyny może zmniejszyć aktywność tego enzymu, a proces ten jest przeprowadzany przez enzym acetylazy znany jako SIRT3; Fosforylacja ma taki sam wpływ na enzym.
Oprócz tych modyfikacji kompleks SDH jest również regulowany przez pośredników cyklu Krebsa, w szczególności Szczawian i bursztynian. Oxalacetan jest silnym inhibitorem, podczas gdy bursztynian sprzyja dysocjacji szczawicy, funkcjonując jako aktywator.
Dehydrogenaza niedoboru impulsynowego
Dehydrogenaza niedoboru bursztynianu jest anomalią lub mitochondrialnym zaburzeniem łańcucha oddechowego. Niedobór ten jest spowodowany przez mutacje SDHA (lub SDHAF1), SDHB, SDHC i SDHD.
Różne badania wykazały homozygotyczne i heterozygotyczne mutacje w tych genach, zwłaszcza SDHA. Mutacje tych genów powodują podstawienia aminokwasów w białku (w dowolnym z SDHA, B, C lub D) lub wady, które kodyfikują nienormalnie krótkie białka.
Dlatego podstawienia aminokwasowe i nieprawidłowo krótkie kodowanie białka, powodują zaburzenia lub zmiany enzymu SDH, które powodują awarię optymalnej pojemności mitochondriów do wytwarzania energii. Tak nazywają naukowcy jako mitochondrialny zaburzenie łańcucha oddechowego.
Zaburzenie to można wyrazić w ludzkiej istocie fenotypowo na wiele sposobów. Najbardziej znane to: niedobór lub brak rozwoju językowego, spastyczne kwadrupleks, mimowolne skurcze mięśni (dystonia), osłabienie mięśni i mięśnia sercowa, między innymi powiązane problemy.
Niektórzy pacjenci z dehydrogenazą niedoboru bursztynianu mogą objawiać chorobę Leight lub zespół Kearnsa-Saire.
Jak wykrywa się odwodorniony niedobór bursztynianu?
Niektóre badania sugerują zastosowanie testów jakościowych i analizy, a także ilościowe, enzymatyczne, biochemiczne analiza łańcucha oddechowego. Inne, z drugiej strony, sugerują całkowite rozszerzenie przez reakcję łańcuchową polimerazy (PCR) eksonów badanych podjednostek, a następnie odpowiednie sekwencjonowanie.
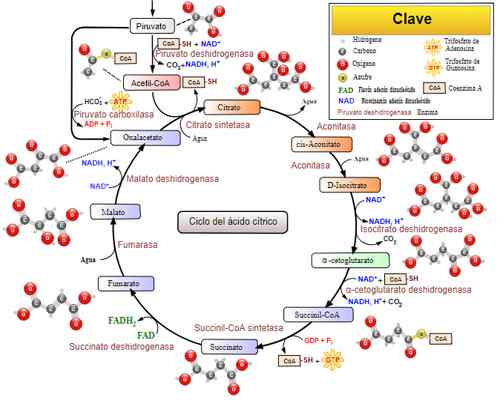 Cykl kwasu trikarboksylowego (cykl Krebsa). Zrobione i zredagowane z: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (przetłumaczone na hiszpański przez Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)].
Cykl kwasu trikarboksylowego (cykl Krebsa). Zrobione i zredagowane z: Narayanese, Wikiuserpedia, Yassinemrabet, Totobaggins (przetłumaczone na hiszpański przez Alejandro Porto) [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]. Powiązane choroby
Istnieje wiele wyrażeń fenotypowych wytwarzanych przez mitochondrialne zaburzenia łańcucha oddechowego, z powodu dehydrogenazy niedoboru bursztynianu. Jednak gdy chodzi o zespoły lub choroby, mówi się o następujących.
Może ci służyć: 8 najważniejszych cykli biogeochemicznych (opis)Zespół Leight
Jest to postępująca choroba neurologiczna, związana z mutacjami w genomie jądrowym (w tym przypadku bursztynianu dehydrogenazy), która wpływa na kompleks pirogronian-dishydrogenazy na oksydacyjną drogę fosforylacji.
Objawy pojawiają się przed pierwszym rokiem jednostki, ale w nietypowych przypadkach zaobserwowano pierwsze objawy w okresie dojrzewania.
Wśród najczęściej zaobserwowanych objawów są: hipotonia z utratą kontroli głowowania, mimowolne ruchy, nawracające wymioty, problemy z oddychaniem, niezdolność do przemieszczania krwinek oka, piramidy i objawów ekstrapiramidowych między innymi między innymi. Napady nie są bardzo powszechne.
Możliwe, że choroba można wykryć w diagnozach prenatalnych. Określone wyleczenie lub leczenie nie jest znane, ale niektórzy specjaliści sugerują leczenie niektórymi witaminami lub kofaktorami.
Guz zrębu żołądkowo -jelitowego (GIST)
Powszechnie nazywany gist, jest to rodzaj guza przewodu pokarmowego, który ogólnie rozwija się w obszarach takich jak żołądek lub jelito cienkie. Uważa się, że ich przyczyna jest pewna grupa wysoce wyspecjalizowanych komórek zwanych komórkami ICC lub komórek śródmiąższowych Cajal.
Inne rozważania dotyczące przyczyny gist są mutacje niektórych rodzajów genów, które według niektórych autorów powodują 90% guzów. Zaangażowane geny to: Kit, geny PDGFRA, bursztynian dehydrogenazy (SDH) -.
Dehydrogenaza bursztynianowa (SDH) - biedna, występuje głównie u młodych kobiet, wytwarza guzy żołądka, a z częstotliwością względną wytwarza przerzuty w węzłach chłonnych. Niewielki procent występuje u dzieci, aw większości przypadków wynika to z braku wyrażenia podjednostki SDHB.
Zespół Kearns-Sayre
Ustalono, że niektórzy pacjenci z niedoborem dehydrogenazy bursztynianowej mogą przejawiać zespół Kearns-Sayre. Ta choroba jest związana z zaburzeniami mitochondriów i charakteryzuje się brakiem ruchu balonów ocznych.
Innymi cechami tej choroby to zapalenie siatkówki pigmentowe, głuchota, kardiomiopatia i warunki ośrodkowy układ nerwowy. Zwykle objawy te są obserwowane, zanim pacjent skończy 20 lat. Żadna diagnoza prenatalna dla tego stanu nie jest znana.
Nie ma też lekarstwa na tę chorobę. Leczenie jest paliatywne, to znaczy tylko w celu zmniejszenia skutków choroby, a nie lekarstwa. Z drugiej strony, chociaż zależy to od liczby dotkniętych narządów i otrzymanej opieki medycznej, długość życia jest stosunkowo normalna.
Bibliografia
- Ackrell, ur. DO., Kearney, e. B., & Singer, t. P. (1978). [47] Dehydrogenaza bursztynianowa ssaków. W metodach enzymologii (vol. 53, pp. 466-483). Academic Press.
- Brère, J. J., Favier, J., Ghuzzi, v. I., Djoudi, f., Benit, s. 1., Gimenez, a. P., & Rustin, p. (2005). Dehydrogenaza bursztynian. Nauk o życiu komórkowym i molekularnym CMLS, 62 (19-20), 2317-2324.
- Cecchini, g., Schröder, ja., Gunalus, r. P., & Maklashina i. (2002). Dehydrogenaza bursztynianowa i redactaza fumerująca z Escherichia coli. Biochimica et Biophysica Acta (BBA) -Bioenergetics, 1553 (1-2), 140-157.
- Hatefi i., & Davis, k. DO. (1971). Dehydrogenaza bursztynianu. Siema. Oczyszczanie, właściwości molekularne i podbudowa. Biochemia, 10 (13), 2509-2516.
- Hederstedt, L. DO. R. S., & Rutberg, L. DO. R. S. (1981). Przegląd porównawczej dehydrogenazy bursztynianowej-A. Mikrobiologiczne recenzje, 45 (4), 542.
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Rutter, J., Winge, d. R., & Schiffman, J. D. (2010). Dehydrogenaza bursztynianowa, regulacja i rola w ludzkim diecie. Mithochondrion, 10 (4), 393-401.
- « Niezbędne funkcje kwasów tłuszczowych, znaczenie, nomenklatura, przykłady
- Reguła T, tak że służy, przykłady »

