Solvation
- 3913
- 19
- Prokul Woliński
Co to jest solvation?
Solvation Jest to fizyczny i chemiczny związek między cząstkami substancji rozpuszczonej i rozpuszczalnika w roztworze. Różni się od koncepcji rozpuszczalności w tym fakcie, że nie ma równowagi termodynamicznej między stałą a jego rozpuszczonymi cząstkami.
Związek ten jest odpowiedzialny za rozpuszczone substancje stałe „znikające” ze względu na widzów; W rzeczywistości cząstki stają się bardzo małe i kończą się „owinięte” arkuszami cząsteczek rozpuszczalnika, co uniemożliwia je obserwowanie.

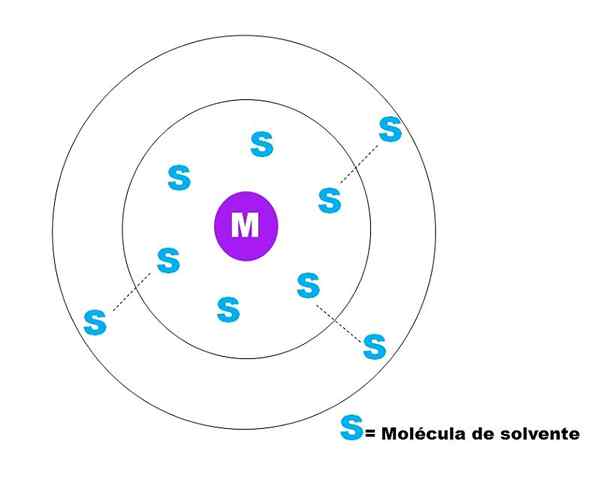
Na górnym obrazie reprezentowany jest bardzo ogólny szkic solwatacji cząstki M. M może być w porządku (m+) lub cząsteczka; A s to cząsteczka rozpuszczalnika, która może być dowolnym związkiem w stanie ciekłym (chociaż może to być również gaz).
Zauważ, że M jest otoczone sześć s, które składają się na tak zwane Pierwotna sfera solwatacyjna. Inne cząsteczki M w większej odległości oddziałują siły Van der Waalsa z pierwszymi, tworząc wtórną sfałę solowania, i tak dalej, aż do wszelkich zamawiania będzie widoczne.
Proces solwatacji
 Źródło: Gabriel Bolívar
Źródło: Gabriel Bolívar Molekularnie, w jaki sposób jest proces solwacji? Górny obraz podsumowuje niezbędne kroki.
Cząsteczki rozpuszczalnika, niebieskie, są początkowo nakazane do interakcji ze sobą (S-S); A cząstki (jony lub cząsteczki) substancji rozpuszczonej, fioletowej, robią to samo z silnymi lub słabymi interakcjami M-M.
Aby wystąpić solvation, zarówno rozpuszczalnik, jak i substancja rozpuszczona muszą rozszerzyć (druga czarna strzałka), aby umożliwić interakcje rozpuszczalnikowe (M-S).
To koniecznie oznacza zmniejszenie interakcji rozpuszczalnika rozpuszczonego i rozpuszczalnika; zmniejszenie, które wymaga energii, a zatem ten pierwszy krok jest endotermiczny.
Gdy substancja rozpuszczona i rozpuszczalnik powiększają się molekularnie, zarówno wymieszaj, jak i wymieniają miejsca w kosmosie. Każde fioletowe okrąg drugiego obrazu można porównać do pierwszego obrazu.
Może ci służyć: wapń: właściwości, struktura, uzyskiwanie, użyciaZmiana stopnia uporządkowania cząstek można szczegółowo opisać na obrazie; zamówione na początku i na końcu niechlujne. W konsekwencji ostatni krok jest egzotermiczny, ponieważ tworzenie nowych interakcji stabilizuje wszystkie cząstki roztworu.
Aspekty energetyczne
Za procesem solwacji istnieje wiele aspektów energii, które należy wziąć pod uwagę. Po pierwsze: interakcje S-S, M-M i M-S.
Gdy interakcje M-S, to znaczy między substancją rozpuszczoną a rozpuszczalnikiem, są one znacznie lepsze (silne i stabilne) w porównaniu z poszczególnymi składnikami, mówi się o egzotermicznym procesie solowania; I dlatego energia jest uwalniana do środowiska, które można zweryfikować poprzez pomiar wzrostu temperatury za pomocą termometru.
Jeśli wręcz przeciwnie, interakcje M-M i S-S są silniejsze niż M-S, wówczas „rozszerzenie” będzie potrzebować więcej energii niż ta, którą zarabiają po zakończeniu solwatacji.
Następnie mówi się o procesie solowania endotermicznego. W tym przypadku następuje spadek temperatury lub to samo, otoczenie chłodne.
Istnieją dwa podstawowe czynniki, które rządzą, czy substancja rozpuszczona rozpuszcza się w rozpuszczalniku. Pierwszym z nich jest zmiana roztworu rozpuszczania (HHDis), Jak wyjaśniono, a druga to zmiana entropii (δS) między substancją rozpuszczoną a rozpuszczoną substancją rozpuszczoną. Zasadniczo δS jest związany ze wzrostem zaburzenia również wspomnianego powyżej.
Interakcje międzycząsteczkowe
Wspomniano, że solwatacja jest wynikiem fizycznego i chemicznego związku między substancją rozpuszczoną a rozpuszczalnikiem; Jednak jak dokładnie są te interakcje lub związki?
Jeśli substancja rozpuszczona jest jonem, m+, Produkowane są tak zwane interakcje jonowe-dipolo (m+-S); A jeśli jest to cząsteczka, będą interakcje dipol-dipolo lub londyńskie siły dyspersji.
Może ci służyć: cykloheksan: struktura, zastosowania, konformacjeMówiąc o interakcjach Dipolo-Dipolo, mówi się, że istnieje stały moment dipolowy w M i S. Zatem region bogaty w elektron. Rezultatem wszystkich tych interakcji jest tworzenie kilku sfer solwatacji wokół M.
Dodatkowo istnieją inne rodzaje interakcji: koordynowanie. Tutaj cząsteczki łączy koordynacji S (lub celownicy) z M, tworząc różne geometrie.
Podstawową zasadą zapamiętywania i przewidywania powinowactwa między substancją rozpuszczoną a rozpuszczalnikiem jest: równe rozpuszcza się równe. Dlatego substancje polarne rozpuszczają się z dużą łatwością w rozpuszczalnikach równo polarnych; i substancje apolowe, rozpuszczaj się w rozpuszczalnikach nietoperzy.
Różnice między solwacją a nawodnieniem
 Źródło: Gabriel Bolívar
Źródło: Gabriel Bolívar Czym różni się rozpuszczanie nawodnienia? Dwa identyczne procesy, z wyjątkiem faktu, że S S, pierwszego obrazu, są zastępowane przez wody, H-O-H.
Na lepszym obrazie widać kation m+ otoczone sześcioma cząsteczkami H2ALBO. Należy zauważyć, że atomy tlenu (czerwonego) są ukierunkowane na dodatnie obciążenie, ponieważ są najbardziej elektroonywacyjne, a zatem ma największą gęstość ujemną δ-.
Za pierwszą kulą nawodnienia inne cząsteczki wody są grupowane przez mosty wodoru (OH2-Oh2). Są to interakcje typu jon-dipolo. Jednak cząsteczki wody mogą również tworzyć wiązania koordynacyjne z dodatnim centrum, szczególnie jeśli jest on metaliczny.
Tak więc słynny Aquokomplejos, m (Oh2)N. Jak n = 6 na obrazie sześć cząsteczek jest zorientowanych wokół M w oktahedronie koordynacji (wewnętrzna kula nawodnienia). W zależności od wielkości m+, Wielkość jego obciążenia i dostępność elektroniczna, powiedziała, że kula może być mniejsza lub większa.
Może ci służyć: chromowany tlenek (iii): struktura, nomenklatura, właściwości, zastosowaniaWoda jest prawdopodobnie najbardziej zaskakującym rozpuszczalnikiem: rozpuszcza niezmierzoną ilość substancji rozpuszczonych, jest rozpuszczalnikiem zbyt polarnym i ma nienormalnie wysoką stałą dielektryczną (78.5 K).
Przykłady rozwiązania
Poniżej znajdują się trzy przykłady solwatacji w wodzie.
Chlorek wapnia
Podczas rozpuszczania chlorku wapnia w wodzie ciepło jest uwalniane po rozwiązaniu kationów CA2+ i aniony CL-. CA2+ Jest otoczony wieloma cząsteczkami wody równej lub większej niż sześć (Ca2+-Oh2).
Także CL- Jest otoczony atomami wodoru, regionem δ+ wody (Cl--H2ALBO). Uwolnione ciepło może być używane do topnienia mas lodowych.
Mocznik
W przypadku mocznika jest to cząsteczka organiczna o strukturze H2N-Co-NH2. Podczas rozwiązywania cząsteczek H2O tworzy mosty wodorowe z dwiema grupami AMING (-NH2-Oh2) i z grupą karbonylową (c = o- h2ALBO). Te interakcje są odpowiedzialne za ich wielką rozpuszczalność w wodzie.
Również jego rozpuszczanie jest endotermiczne, to znaczy ochładza pojemnik na wodę tam, gdzie jest dodawany.
Azotan amonowy
Azotan amonu, podobnie jak mocznik, jest substancją substancji rozpuszczonej, która chłodzi rozpuszczanie po solwatowaniu jego jonów. NH4+ Solvata podobnie jak CA2+, Chociaż prawdopodobnie dlatego, że jest to geometria czworościenna ma mniej cząsteczek H2Lub wokół niego; I nie3- Solvata w taki sam sposób jak aniony CL- (Oh2-ALBO2No- h2ALBO).
Bibliografia
- Whitten, Davis, Peck i Stanley. Chemia. (8 wyd.). Cengage Learning.
- Belford r. (S.F.). Procesy solwatacji. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Guppy Surf. (S.F.). Proces solwatacji. Źródło: Surfgupy.com

