Izotoniczne elementy roztworu, przygotowanie, przykłady
- 4611
- 227
- Estera Wojtkowiak
A roztwór izotoniczny Jest to taki, który przedstawia to samo stężenie substancji rozpuszczonej w odniesieniu do roztworu oddzielonego lub izolowanego przez półprzepuszczalny błąd. Ta bariera umożliwia rozpuszczalnik na transte, ale nie wszystkie cząsteczki substancji rozpuszczonej.
W fizjologii ten izolowany roztwór odnosi się do płynu wewnątrzkomórkowego, czyli wnętrze komórek; Podczas gdy półprzepuszczalna bariera odpowiada błonie komórkowej, utworzona przez biologiczną lipidową biurkę.
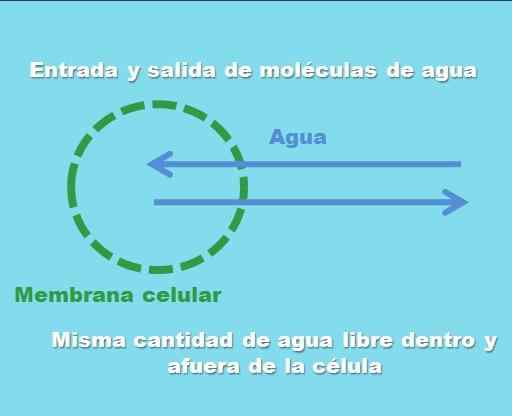
 Interakcja komórki z roztworem izotonicznym. Źródło: Gabriel Bolívar.
Interakcja komórki z roztworem izotonicznym. Źródło: Gabriel Bolívar. Najwyższy obraz ilustruje to, co oznacza roztwór izotoniczny. „Stężenie” wody jest takie samo wewnątrz i na zewnątrz komórki, więc ich cząsteczki wchodzą lub wychodzą przez błonę komórkową z równymi częstotliwościami. Dlatego jeśli dwie cząsteczki wody wejdą do komórki, dwa z nich odejdą jednocześnie w kierunku pożywki pozakomórkowej.
Ten stan, zwany izotonicznością, odbywa się tylko wtedy, gdy pożywka wodna, wewnątrz i na zewnątrz komórki, zawiera tę samą liczbę rozpuszczonych cząstek substancji rozpuszczonej. Zatem roztwór będzie izotoniczny, jeśli stężenie jego substancji rozpuszczonych jest podobne do stężenia płynu lub pożywki wewnątrzkomórkowej. Na przykład 0,9% roztwór soli fizjologicznej jest izotoniczny.
[TOC]
Składniki rozwiązań izotonicznych
Aby istniało rozwiązanie izotoniczne, musi najpierw upewnić się, że osmoza występuje w roztworze lub rozpuszczalniku. Jest to możliwe tylko wtedy, gdy obecna jest półprzepuszczalna bariera, co pozwala na jej przeniesienie cząsteczek rozpuszczalnika, ale nie z substancji rozpuszczonej, zwłaszcza rozpuszczonych elektrycznie, jony.
Zatem substancji rozpuszczonej nie można rozprzestrzeniać z bardziej skoncentrowanych regionów na bardziej rozcieńczone regiony. Zamiast tego będą to cząsteczki wody, które przemieszczają się z jednego miejsca do drugiego, przekraczając półprzepuszczalną barierę i odbywają się osmoza. W systemach wodnych i biologicznych barierą tę jest par doskonałości błony komórkowej.
Może ci służyć: konkurencja (biologia): cechy, typy, przykładyPosiadanie półprzepuszczalnej bariery i pożywki rozpuszczalnikowej, konieczna jest również obecność rozpuszczonych jonów lub soli w obu mediach: wewnętrzna (wewnątrz bariery) i zewnętrzna (poza barierą).
Jeśli stężenie tych jonów jest takie samo po obu stronach, wówczas nie będzie nadmiaru ani deficytu cząsteczek wody, aby je rozwiązać. Oznacza to, że liczba cząsteczek bez wody jest taka sama, a zatem nie przenoszą one półprzepuszczalnej bariery w dowolnym miejscu w celu dopasowania stężeń jonów.
Przygotowanie
- Warunki i równanie
Chociaż roztwór izotoniczny można przygotować z dowolnym rozpuszczalnikiem, ponieważ woda jest pożywką komórek, jest to uważane za ulubioną opcję. Znając dokładnie stężenie soli w określonym ciele ciała lub w krwioobiegu, możliwe jest oszacowanie, ile soli musi rozpuścić w danej objętości.
W organizmach kręgowców przyjmuje się, że średnio stężenie substancji rozpuszczonych w osoczu krwi wynosi około 300 mosm/l (miliosmolarność), jest w stanie interpretować prawie 300 mmol/l. To znaczy jest bardzo rozcieńczone stężenie. Aby oszacować miliosolarność, należy zastosować następujące równanie:
Osmolarność = m · v · g
Zakłada się, że do celów praktycznych G, Współczynnik osmotyczny ma wartość 1. Aby równanie było teraz jako:
Osmolarity = m · v
Gdzie M Jest to molowość substancji rozpuszczonej i v Liczba cząstek, w których wspomniana substancja rozpuszczona jest w wodzie. Następnie pomnożamy tę wartość przez 1.000 w celu uzyskania miliosmolarności dla określonej substancji rozpuszczonej.
Może ci służyć: czym jest homoplasia? (Z przykładami)Jeśli istnieje więcej niż jedna substancja substancji rozpuszczonej, całkowita miliosolarność roztworu będzie sumą tysiącości dla każdej substancji rozpuszczonej. Im bardziej substancja rozpuszczona w odniesieniu do wnętrza komórek, tym mniej izotoniczne będzie przygotowanym roztworem.
- Przykład przygotowania
Załóżmy, że chcesz przygotować litr roztworu izotonicznego opartego na fosforanach glukozy i sodu. Ile powinno być ważącym glukozę? Załóżmy, że zostanie użyte 15 gramów nah2PO4.
Pierwszy krok
Musimy najpierw określić osmolarność Nah2PO4 Obliczanie jego molowości. Aby to zrobić, zwracamy się do masy molowej lub masy cząsteczkowej, 120 g/mol. Ponieważ jesteśmy proszeni o litr roztworu, określamy mole i będziemy mieli bezpośrednio molowość:
Mole (nah2PO4) = 15 g ÷ 120 g/mol
= 0,125 mol
M (nie2PO4) = 0,125 mol/l
Ale kiedy nah2PO4 Rozpuszcza się w wodzie, uwalnia kationę+ i anion h2PO4-, stąd v Ma wartość 2 w równaniu osmolarnym. Następnie obliczamy dla Nah2PO4:
Osmolarity = m · v
= 0,125 mol/l · 2
= 0,25 OSM/L
I pomnożenie go przez 1.000 mamy miliosmolarność Nah2PO4:
0,25 OSM/L · 1.000 = 250 mosm/l
Drugi krok
Ponieważ całkowita miliosolarność roztworu musi być równa 300 mosm/l, odejmujemy, aby wiedzieć, jaka powinna być glukoza:
MOSM/L (glukoza) = MOSM/L (ogółem) - MOSM/L (Nah2PO4)
= 300 MOSM/L - 250 MOSM/L
= 50 mosm/l
Ponieważ glukoza nie dysocjuje, v Vale 1 i jego osmolarność jest równa jej molowości:
M (glukoza) = 50 mosm/l ÷ 1.000
= 0,05 mol/l
Będąc molem glukozy 180 g/mol, w końcu ustalamy, ile gramów musimy zważyć, aby rozpuścić go w tym litorze roztworu izotonicznego:
Może ci służyć: Renina: Struktura, produkcja, wydzielanie, funkcjeMasa (glukoza) = 0,05 mol · 180 g/mol
= 9 g
Dlatego to roztwór izotoniczny Nah2PO4/glukoza przygotowuje 15 gramów Nah2PO4 i 9 gramów glukozy w litrom wody.
Przykłady rozwiązań izotonicznych
Roztwory izotoniczne lub ciecze nie powodują żadnego gradientu ani zmiany stężenia jonów w ciele, więc ich działanie zasadniczo koncentruje się na nawadnianiu pacjentów, którzy otrzymują je w przypadku krwawienia lub odwodnienia.
Normalna sól fizjologiczna
Jednym z tych roztworów jest normalna sól fizjologiczna, ze stężeniem 0,9% NaCl.
Roztwór mleczanu dzwonka
Inne roztwory izotoniczne stosowane w tym samym celu to roztwór mleczanu ringera, który zmniejsza kwasowość ze względu na jego bufor lub skład tłumiący oraz roztwory fosforanu Sorensena, które składają się z fosforanów i chlorku sodu.
Systemy niekwarte
Izotoniczność może być również stosowana do systemów innych niż te, takie jak te, w których rozpuszczalnik jest alkoholem; Tak długo, istnieje półprzepuszczalna bariera, która sprzyja przezroczystość cząsteczek alkoholu i zachowuje cząstki substancji rozpuszczonej.
Bibliografia
- Od Lehr Spilva, do. I Muktany i. (1999). Przewodnik po specjalnościach farmaceutycznych w Wenezueli. XXXVª Edition. Globalne wydania.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Elsevier b.V. (2020). ROZTWÓR IZOTONICZNY. Pobrano z: Scientedirect.com
- Adrienne Brundage. (2020). Rozwiązanie izotoniczne: definicja i przykład. Badanie. Odzyskane z: Study.com
- Felicitas Merino de la Hoz. (S.F.). Seroterapia dożylna. University of Cantabria. [PDF]. Odzyskane z: OCW.Unican.Jest
- Laboratorium farmaceutyczne i złożone. (2020). Przygotowania okulistyczne: bufory izotoniczne. Odzyskane z: PharmLabs.Unc.Edu

