Hipotoniczne elementy roztworu, przygotowanie, przykłady
- 5088
- 690
- Maksymilian Kępa
A Roztwór hipotoniczny Jest to taki, który przedstawia stężenie mniejszej substancji rozpuszczonej w odniesieniu do roztworu oddzielonego lub izolowanego przez półprzepuszczalny błąd. Ta bariera umożliwia rozpuszczalnik do Transte, wodę w przypadku układów biologicznych, ale nie wszystkie cząstki substancji rozpuszczonej.
Płyny ustrojowe kręgowców wewnątrzkomórkowych i zewnątrzkomórkowych mają osmolarność około 300 mosm/l. Chociaż uważa się, że ciecz hipotoniczna ma osmolarność mniejszą niż 280 mosm/l. Tak więc roztwór tej osmolarności jest hipotoniczny w odniesieniu do pożywki komórkowej.
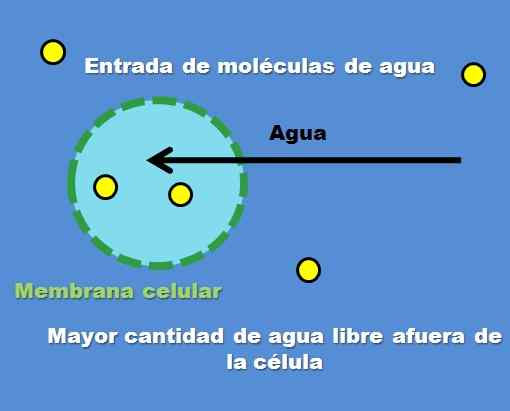
 Interakcja komórki z roztworem hipotonicznym. Źródło: Gabriel Bolívar.
Interakcja komórki z roztworem hipotonicznym. Źródło: Gabriel Bolívar. Przykładem roztworu hipotonicznego jest 0,45% chlorku sodu. Ale w jaki sposób komórka lub przedział zachowuje się przed tego rodzaju rozwiązaniem? Najwyższy obraz odpowiada na to pytanie.
Stężenie cząstek substancji rozpuszczonej (żółte punkty) jest wyższe w komórce zewnętrznej. Mając mniej substancji rozpuszczonej wokół komórki, istnieje więcej wolnych cząsteczek wody, więc jest ona reprezentowana z bardziej intensywnym niebieskim kolorem w porównaniu z wnętrzem komórki.
Woda przepływa na zewnątrz przez osmozę do stężenia poziomu. W rezultacie komórka rozszerza się lub wachlarz poprzez wchłanianie wody, która przecina błonę komórkową.
[TOC]
Składniki roztworów hipotonicznych
Roztwory hipotoniczne składają się z rozpuszczalnika, który, o ile nie wskazano inaczej, składa się z wody i rozpuszczonych w nim substancji rozpuszczonych, takich jak sole, cukry itp., w czystej lub mieszanej formie. Ale to rozwiązanie nie będzie miało żadnej toniczności, jeśli nie będzie półprzepuszczalnej bariery, która staje się błoną komórkową.
Może ci podać: azotan wapnia (CA (NO3) 2)Musi istnieć niewiele rozpuszczonych soli, aby jego stężenie było małe, podczas gdy „stężenie” wody jest wysokie. Posiadanie większej wolnej wody poza komórką, to znaczy nie rozwiązuje ani nie nawadnia cząstek substancji rozpuszczonej, tym większe jej ciśnienie na błonie komórkowej i więcej będzie miało tendencję do przekraczania jej w celu rozcieńczenia płynu wewnątrzkomórkowego.
Przygotowanie roztworu hipotonicznego
W celu przygotowania tych rozwiązań stosuje się ten sam protokół, jak następuje inne rozwiązania. Dokonywane są odpowiednie obliczenia masy substancji rozpuszczonych. Następnie są one ważone, rozpuszczają się w wodzie i weź flagę udostępnioną do objętości, która odpowiada.
Roztwór hipotoniczny ma niską osmolarność, zwykle mniej niż 280 mOSM/L. Więc przygotowując roztwór hipotoniczny, musimy obliczyć twoją osmolarność w taki sposób, że jej wartość jest mniejsza niż 280 mosm/l. Osmolarność można obliczyć za pomocą następującego równania:
Osmolarność = m · v · g
Gdzie M Jest to molowość substancji rozpuszczonej i v Liczba cząstek, w których związek jest zdysocjowany w roztworze. Substancje nieelektrolityczne nie dysocjują, więc wartość V jest równa 1. Tak jest w przypadku glukozy i innych cukrów.
Chwila G jest współczynnikiem osmotycznym. Jest to współczynnik korekcji interakcji cząstek naładowanych elektrycznie (jonów) w roztworze. Na przykład dla rozcieńczonych roztworów i substancji nieadistorate i ponownie glukozy, pobrana jest wartość g równa 1. Mówi się wtedy, że trzonowość jest identyczna z jej osmolarnością.
Przykład 1
Przygotuj roztwór chlorku sodu (NaCl) przy 0,5 % (P/V), sprawdzając, czy jest to roztwór hipotoniczny. NaCl Masa cząsteczkowa = 58,5 g/mol.
Przenosi się 0,5 % roztwór Gram NaCl na litr:
Może ci służyć: nadtlenek wapnia (CAO2): właściwości, ryzyko i zastosowaniaNaCl w g/l = (0,5 g ÷ 100 ml) · 1.000 ml
= 5 g/l
I przystępujemy do obliczania jego molowości, a następnie określamy jej osmolarność:
Miłowość = masa (g/l) ÷ masa cząsteczkowa (g/mol)
= 5 g/l ÷ 58,5 g/mol
= 0,085 mole/l
NaCl dysocjuje dwie cząstki: na+ (kation) i cl- (anion). Więc wartość v = 2. Ponadto, ponieważ jest to rozcieńczone roztwór 0,5 %NaCl, można założyć, że wartość G (współczynnik osmotyczny) wynosi 1. Mamy wtedy:
Osmolarność (NaCl) = molo · v · g
= 0,085 m · 2 · 1
= 0,170 OSM/L O 170 MOSM/L
Jest to roztwór hipotoniczny, ponieważ jego osmolarność jest znacznie niższa niż referencyjna osmolarność płynów ustrojowych, która jest osmolarnością w osoczu, której wartość wynosi około 300 mOSM/L L.
Przykład 2
Przygotuj roztwór mieszaniny chlorku wapnia (CACL2) przy 0,055 % (P/V) i glukozie (C6H12ALBO6) przy 4 % (P/V). Waga cząsteczkowa: CACL2 = 111 g/mol i c6H12ALBO6 = 180 g/mol.
Obliczamy molowość o stężeniach odpowiednich substancji rozpuszczonych przy 0,55 g/l i 40 g/l:
Molowość (CACL2) = 0,55 g/l ÷ 111 g/mol
= 4,95 · 10-3 M
= 4,95 mm
Molowość (c6H12ALBO6) = 40 g/l ÷ 180 g/mol
= 0,222 m
= 222 mm
I w ten sam sposób obliczamy osmolarność, wiedząc, że kliknięcie2 Dysocjatuje na trzech jonach, dwa Cl- I CA2+, i zakładając, że są to bardzo rozcieńczone rozwiązania, więc wartość v To jest 1. Mamy:
Osmolarność (CACL2) = 4,95 mm · 3 · 1
= 14,85 MOSM/L
Osmolowość (c6H12ALBO6) = 222 mm · 1 · 1
= 222 MOSM/L
Wreszcie całkowita osmolarność roztworu staje się sumą poszczególnych osmolarności; to znaczy z tych z NaCl i glukozy. To jest zatem:
Może ci służyć: materiały ogniotrwałeCałkowita osmolarność roztworu = osmolarność CACL2 + Osmolarność c6H12ALBO6
= 222 MOSM/L + 14,85 MOSM/L
= 236,85 MOSM/L
Roztwór mieszaniny chlorku wapnia i glukozy jest hipotoniczny, ponieważ jego osmolarność (236,85 MOSM/L) jest znacznie mniejsza niż osmolarność w osoczu (300 MOSM/L), która jest uznawana za odniesienie.
Przykłady roztworów hipotonicznych
Roztwór chlorku sodu
0,45 % roztwór chlorku sodu jest dożylnie podawany u pacjentów z ketozą cukrzycową, którzy rozwijają odwodnienie w przedziałach śródmiąższowych i wewnątrzkomórkowych. Woda płynie z osocza do tych przedziałów.
Roztwór mleczanu dzwonka
Roztwór mleczanu dzwonka nr 19 to kolejny przykład roztworu hipotonicznego. Jego skład wynosi 0,6 g chlorku sodu, 0,03 g chlorku potasu, 0,02 g chlorku wapnia, 0,31 g mleczanu sodu i 100 ml wody destylowanej. Jest to rozwiązanie stosowane do nawodnienia pacjenta i jest lekko hipotoniczne (274 mosm/l).
Bibliografia
- Od Lehr Spilva, do. I Muktany i. (1999). Przewodnik po specjalnościach farmaceutycznych w Wenezueli. XXXVª Edition. Globalne wydania.
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Wikipedia. (2020). Toniczność. Źródło: w:.Wikipedia.org
- Union Media LLC. (2020). Rozwiązania izotoniczne, hipotoniczne i hipertoniczne. Źródło: UnionTestprep.com
- Lodish H, Berk A, Zipursky SL, i in. (2000). Sekcja 15.8osmoza, kanały wodne i regulacja objętości komórek. NCBI półka z książkami. Odzyskane z: NCBI.NLM.Nih.Gov
- John Brennan. (13 marca 2018 r.). Jak obliczyć izotoniczność. Odzyskane z: naukowe.com

