Charakterystyka seryny, funkcje, metabolizm, żywność
- 786
- 116
- Bertrand Zawadzki
Serine Jest to jeden z 22 podstawowych aminokwasów, chociaż nie jest to klasyfikowane jako niezbędny aminokwas dla człowieka i innych zwierząt, ponieważ jest syntetyzowany przez ludzkie ciało.
Według nomenklatury trzech liter, seryna jest opisana w literaturze jako istota (s w jednym kodzie literowym). Ten aminokwas uczestniczy w dużej liczbie dróg metabolicznych i ma charakterystykę polarną, ale nie ma obciążenia neutralnego pH.
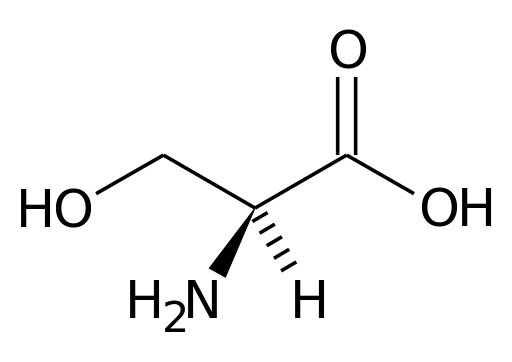
 Reprezentacja serii aminokwasu serynowego (źródło: Pagecepe w IT.Wikipedia [domena publiczna] za pośrednictwem Wikimedia Commons)
Reprezentacja serii aminokwasu serynowego (źródło: Pagecepe w IT.Wikipedia [domena publiczna] za pośrednictwem Wikimedia Commons) Wiele ważnych enzymów dla komórek ma wiele.
Seryn, wśród wielu jej funkcji, uczestniczy jako cząsteczka prekursora i rusztowania w biosyntezy innych aminokwasów, takich jak glicyna i cysteina i jest częścią struktury sfingolipidów obecnych w błonach komórkowych w błonach komórkowych.
Szybkość syntezy seryny zmienia się w każdym narządie, a ponadto zmienia się w zależności od etapu rozwoju.
Naukowcy zaproponowali, że stężenie L-Serine w tkance mózgu wzrasta wraz z wiekiem, ponieważ przepuszczalność bariery krwinek zmniejsza się w mózgu dorosłego, ponieważ jest w stanie powodować ciężkie zaburzenia mózgu.
Wiadomo, że L-seryna ma zasadnicze znaczenie dla biosyntezy neurotransmiterów, fosfolipidów i innych złożonych makrocząsteczek, ponieważ zapewnia prekursory tych wielu szlaków metabolicznych.
Różne badania wykazały, że podaż suplementów lub koncentratów L-Serine u niektórych rodzajów pacjentów poprawia homeostazę glukozy, funkcję mitochondriów i zmniejszają śmierć neuronów.
[TOC]
Charakterystyka i struktura
Wszystkie aminokwasy mają jako podstawową strukturę grupę karboksylową i grupę aminową przymocowaną do tego samego atomu węgla; Jednak różnią się one od siebie według ich łańcuchów, znanych jako grupy R, które mogą różnić się rozmiarem, strukturą, a nawet ładunkiem elektrycznym
Seryn zawiera trzy atomy węgla: z jednej strony United Central Carbon do grupy karboksylowej (COOH) i z drugiej grupy aminowej (NH3+). Pozostałe dwa centralne wiązania węglowe są zajęte przez atom wodoru i grupa CH2OH (grupa R), charakterystyczna dla seryny.
Centralny węgiel, do którego grupy amino i karboksylowe aminokwasów są znane jako węgiel α. Pozostałe atomy węgla grup R są oznaczone literami greckiego alfabetu.
Na przykład w przypadku seryny jedyny atom węgla w jego grupie R, który jest powiązany z grupą OH, jest znany jako węgiel γ.
Może ci służyć: fosfatydilseryna: struktura, synteza, funkcje, lokalizacjaKlasyfikacja
Seryna jest klasyfikowana w grupie aminokwasów polarnych bez obciążenia. Członkowie tej grupy to bardzo rozpuszczalne aminokwasy w wodzie, to znaczy są związkami hydrofilowymi. W serynie i treminie hydrofilowość wynika z jej zdolności do tworzenia mostów wodorowych z wodą przez jej grupy hydroksylowe (OH).
W grupie aminokwasów polarnych bez obciążenia cysteina, asparagina i glutamina są również grupowane razem. Wszystkie z nich mają grupę polarną w łańcuchu R, jednak grupa ta nie jest jonizowana, a pH zbliża się do neutralności anuluj ich ładunki wytwarzające związek w postaci ”Ziterion".
Stereochemia
Ogólna asymetria aminokwasów sprawia, że stereochemia tych związków o zasadniczym znaczeniu w trasach metabolicznych, w których uczestniczą. W przypadku seryny można to znaleźć jako d-O-l-serine, będąc tym ostatnim syntetyzowanym wyłącznie przez komórki układu nerwowego znane jako astrocyty.
Węglowodany α aminokwasów są chiralnym węglemi, ponieważ mają cztery różne zjednoczone podstawniki, które wytwarzają, że istnieją co najmniej dwa wyróżniające się stereoizomery dla każdego aminokwasowego.
Stereoizomer to lustrzany obraz cząsteczki, to znaczy nie można nakładać jednego na drugą. Roztwory tych aminokwasów obracają spolaryzowaną płaszczyznę światła w przeciwnych kierunkach w przeciwnych kierunkach są oznaczone literą d o eksperymentalnie.
L-seryna, która jest syntetyzowana w komórkach układu nerwowego, służy jako substrat do syntezy glicyny lub D-Serine. D-serina jest jednym z najważniejszych elementów wymiany pęcherzyków między neuronami, więc niektórzy autorzy proponują, że obie izoformy serynowe są w rzeczywistości niezbędnymi aminokwasami dla neuronów dla neuronów.
Funkcje
Grupa OH seryny w łańcuchu R czyni go dobrym nukleofilem, więc jest kluczowy dla aktywności wielu enzymów z serynem w aktywnych miejscach. Serine jest jednym z niezbędnych substratów dla synteza Nadph i glutationowego nukleotydów.
Seria L jest niezbędna do rozwoju i właściwego funkcjonowania ośrodkowego układu nerwowego. Badania wykazały, że egzogenna podaż L-serine w niskich dawkach do neuronów hipokampa i komórek Purkinjego In vitro, Poprawia twoje przetrwanie.
Kilka badań komórek rakowych i limfocytów stwierdzono, że jednostki węglowe zależne od seryny są niezbędne do nadmiernego produkcji nukleotydów, a także do późniejszej proliferacji komórek rakowych.
Może ci służyć: mikrobiota: skład, funkcje i gdzie to jestSelenocysteina jest częścią 22 podstawowych aminokwasów i jest uzyskiwana tylko jako pochodna seryny. Ten aminokwas zaobserwowano tylko w niektórych białkach, zawiera selen zamiast siarki przyłączonej do cysteiny i jest syntetyzowany na podstawie sterylowanej seryny.
Biosynteza
Seryna jest nieistotnym aminokwasem, ponieważ jest syntetyzowana przez ludzkie ciało. Można to jednak zasymilować z diety różnych źródeł, takich jak białka i fosfolipidy, głównie.
Seryna jest syntetyzowana w swojej postaci przez konwersję cząsteczki glicyny, reakcji za pośrednictwem enzymu hydroksymetylo-transferazy.
Wiadomo, że głównym miejscem syntezy L-seryny jest astrocyty, a nie w neuronach. To te komórki, synteza występuje drogą fosforylacji, w której uczestniczy 3-fosfoglikaner.
Trzy enzymy działają na tę trasę: 3-fosfogliceryniane dehydrogenaza, transferaza fosfoseryny i fosfoseryna-fosfataza.
Inne ważne narządy w odniesieniu do syntezy seryny są wątroba, nerki, jądra i śledziona. Enzymy, które syntetyzują serynę.
Jedną z pierwszych dróg syntezy znanej seryny był szlak kataboliczny zaangażowany w glukoneogenezę, gdzie L-seryna jest uzyskiwana jako wtórny metabolit. Jednak wkład tej drogi do produkcji seryny ciała jest niski.
Metabolizm
Obecnie wiadomo, że serynę można uzyskać z metabolizmu węglowodanów w wątrobie, gdzie powstaje kwas D-gliceryczny, kwas 3-fosfogliceryczny i kwas 3-fosfohydroksypirúvinowy. Dzięki procesie transaminacji między kwasem 3-hydroksi piruwicznym a alaniną wytwarzana jest seryna.
Eksperymenty z szczurami radioaktywnie oznaczając węgiel 4 glukozy, doszły do wniosku, że węgiel ten jest skutecznie włączony do szkieletów węglowych seryny, co sugeruje, że wspomniany aminokwas ma prekursor trzech węglowodanów prawdopodobnie z pirogronianu.
W bakteriach enzym L-Serine-desaminaza jest głównym enzymem odpowiedzialnym za metabolizowanie seryny: przekształca L-Serinę w pirogronian. Wiadomo, że ten enzym jest obecny i aktywny w uprawach I. coli Przyznawanie minimalnych mediów z glukozą.
Nie wiadomo na pewno, jaka jest prawdziwa funkcja desaminazy L-Serine w tych mikroorganizmach, ponieważ jej ekspresja jest indukowana przez efektory mutacyjne, które uszkadzają DNA promieniowaniem ultrafioletowym, ze względu na obecność Nalidíxico, mitominicyny i innych, mitominicyny i inni, więc wynika z tego, że musi mieć ważne implikacje fizjologiczne.
Może ci podać: Dryopithecus: odkrycie, cechy, czaszka, jedzenieŻywność bogata w seryę
Wszystkie pokarmy o wysokich stężeniach białka są bogate w serynę, głównie jaja, mięso i ryby. Jest to jednak nieistotne aminokwas, więc nie jest ściśle konieczne spożycie go, jeśli chodzi o fakt, że ciało jest w stanie samodzielnie go zsyntetyzować.
Niektóre osoby cierpią na nietypowe zaburzenie, ponieważ mają fenotyp niedoboru w odniesieniu do mechanizmów syntezy seryny i glicyny, dlatego muszą spożywać skoncentrowane suplementy pokarmowe dla obu aminokwasów.
Ponadto marki komercyjne specjalizujące się w sprzedaży suplementów witaminowych (Lamberts, Now Sport i Holomega) oferują koncentraty fosfatydyloseriny i L-serine w celu zwiększenia produkcji masy mięśniowej u sportowców o wysokich zawodach i ciężarów.
Powiązane choroby
Nieprawidłowe działanie enzymów zaangażowanych w biosyntezę seryny może powodować poważne patologie. Poprzez zmniejszenie stężenia seryny w osoczu krwi i płynu mózgowo -rdzeniowym może powodować hipertonię, opóźnienie psychomotoryczne, mikroghalię, padaczkę i złożone zaburzenia ośrodkowego układu nerwowego.
Obecnie odkryto, że niedobór seryny bierze udział w rozwoju cukrzycy, ponieważ L-seryna jest niezbędna do syntezy insuliny i jej receptorów.
Niemowlęta, które prezentują wady w biosyntezy serynowej, są neurologicznie nieprawidłowe przy urodzeniu, mają opóźnienia we wzroście wewnątrzmacicznym, wrodzonej mikroghalii, zaćmy, napadach i poważnym opóźnieniu rozwoju neurologicznego.
Bibliografia
- Elsila, J. I., Dworkin, J. P., Bernstein, m. P., Martin, m. P., & Sandford, s. DO. (2007). Mechanizmy tworzenia aminokwasów w analogach lodu międzygwiezdnych. The Astrophysical Journal, 660 (1), 911.
- Ichord, r. N., I Bearden, D. R. (2017). Encefalopatie metaboliczne okołoporodowe. W neurologii pediatrycznej Swaimana (PP. 171-177). Elsevier.
- Mothet, j. P., Rodzic, a. T., Wolosker, godz., Brady, r. ALBO., Linden, zm. J., Ferris, c. D.,… & Snyder, s. H. (2000). D-seryna jest endogennym ligandem dla miejsca glicyny odbiornika N-metylo-D-apartinian. Materiały z National Academy of Sciences, 97 (9), 4926-4931
- Nelson, zm. L., Lehninger, a. L., & Cox, m. M. (2008). Zasady biochemii lehninger. Macmillan.
- Rodríguez, a. I., Ducker, g. S., Billingham, L. K., Martinez, c. DO., Mainolfi, n., Suri, v.,… & Żyrandel, n. S. (2019). Metabolizm serynowy wspiera produkcję makrofagów IL-1β. Metabolizm komórkowy, 29 (4), 1003-1011.
- Tabatabaie, L., KLOMP, L. W., Berger, r., & Koning, t. J. (2010). Synteza L-Serine w ośrodkowym układzie nerwowym: przegląd zaburzeń niedoboru seryny. Genetyka i metabolizm molekularny, 99 (3), 256-262.
- « Struktura gliceraldehydu, charakterystyka, funkcje
- Historia cynku, właściwości, struktura, ryzyko, użycia »

