Struktura gliceraldehydu, charakterystyka, funkcje
- 1331
- 110
- Prokul Woliński
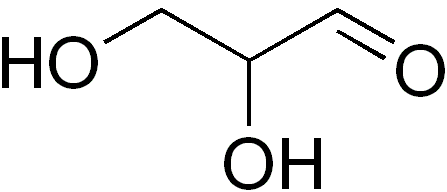
On gliceraldehyd Jest to jedyny trzybony monosacharydów, z kolei jedyną triosa. Jest to również aldotriosa, ponieważ ma grupę aldehydu. Słowo gliceraldehyd pochodzi z kombinacji gliceryny i aldehydu. Wynika to z faktu, że gliceraldehyd jest podobny do gliceryny, ale węgiel jeden (C-1) jest aldehydem.
Chemiczna synteza gliceraldehydu jest przeprowadzana na przykład różnymi metodami, stosując enzymy. Gliceraldehyd jest raczej reaktywną cząsteczką, która jest w stanie tworzyć oburzające między białkami.
 Źródło: DRTW w Dutch Wikedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Źródło: DRTW w Dutch Wikedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] [TOC]
Struktura
Gliceraldehyd ma centrum asymetryczne lub chiralne (atom węgla 2, C-2). Tworzy dwa enancjomery D (dekstrogyr) i L (levógiro), które obracają płaszczyznę spolaryzowanego światła w przeciwnych kierunkach: d-gliceraldehyd obraca go w prawo, a L-gliceraldehydu w lewym.
Specyficzny obrót optyczny d-gliceraldehydu, w 25 °. D-gliceraldehyd często występuje w naturze, głównie jako 3-fosforan gliceraldehydu.
Konfiguracja L-gliceraldehydu jest stosowana w sposób standardowy odniesienie do węglowodanów. W biologicznych cząsteczkach D-Sugar obfituje. Atom węgla 3 (C-3) gliceraldehydu jest grupą hydroksymetylenu (-ch2OH).
Charakterystyka
Kryształy gliceraldehydu są bezbarwne i mają słodki smak. Empiryczna formuła tego cukru to c3H6ALBO3 a jego masa cząsteczkowa wynosi 90 g/mol.
W roztworze wodnym dl-gliceraldehyd jest obecny głównie jako aldehydrol, który jest uwodnioną postacią aldehydu. Krystaliczny DL-gliceraldehido jest dimic.
Analiza kryształów gliceraldehydu według promieni rentgenowski.
W roztworze wodnym gliceraldehyd doświadcza samookaleczenia generującego wolne rodniki. Jest to związane z szybkim zużyciem tlenu.
Może ci służyć: protocourationPrędkość zużycia tlenu powoli zmniejsza się w obecności dysmutazy nadtlenkowej. Sugeruje to, że podczas autoksydacji gliceraldehydowej występuje nadtlenek. Ograniczające przejście autoksydu gliceraldehydu
Synteza d-gliceraldehydu jest katalizowana przez pierwotne i wtórne aminokwasy, które są preferowane do niskich wartości pH (od 3 do 4).
Funkcje
W krzyżowaniu między białkami
Interakcja białko-białko jest molekularnym mechanizmem wielu złożonych procesów biologicznych. Te interakcje mogą być przejściowe, będąc interakcją białka z szlaku metabolicznego lub translacji sygnału.
Chemiczne sieciowanie stanowi bezpośrednią metodę identyfikacji przejściowych i stabilnych interakcji białko-białko.
Technika krzyżowania między białkiem polega na tworzeniu wiązań kowalencyjnych, dla których stosowane są czynniki, które mają dwufucówne grupy reaktywne, które reagują z grupami aminowymi i grupami odpadów aminokwasowych białek.
W szczególności środki reagują z pierwotnymi grupami AMING (takimi jak epsilon-amino marnotrawstwa lizyn) i tworzą przecinanie zarówno podjednostki białek, jak i między podjednostkami białkowymi.
Istnieje wiele różnych dostępnych na rynku agentów. Chociaż gliceraldehyd jest środkiem krzyżowym, istnieją inne bardziej popularne czynniki, takie jak glutaraldehyd. Wynika to z faktu, że gluteraldehyd utrzymuje sztywność strukturalną białka, co jest ważnym wymogiem w wielu badaniach.
Innymi popularnymi agentami to homobowe imiderery, które różnią się długością ramienia dystansowego wśród grup reaktywnych. Niektóre przykłady imidoesterów to apimidato dimetylu (DMA), suberymidowanie dimetylu (DMS) i dimetyl Pimilimidato (DMP).
Może ci służyć: homopolisacharydy: cechy, struktura, funkcje, przykładyW krzyżowaniu między mikrosferami żelatyny
Mikrosfery żelatyny mogą służyć do kontrolowanego uwalniania leku. Wynika to z faktu, że te mikrosfery nie są toksyczne i że ich produkty są łatwo wydalane. Jednak żelatyna jest rozpuszczalnym polimerem, więc należy ją zmodyfikować chemicznie, aby służyć jako system wysyłki leków.
D, L-gliceraldehyd można uznać za nietoksyczny środek sieciujący (dawka śmiertelna, DL50 i.P. U szczurów wynosi 2000 mg/kg). Ponadto w ludzkim ciele d-gliceraldehyd jest fosforylowany przez kinazę triosa. W ten sposób powstaje 3-fosforanowy gliceraldehyd, który wchodził.
Leczenie mikrosfer żelatynowych D, L-gliceraldehydem przez 24 godziny wytwarza mikrosfery z wieloma zmniejszonymi wolnymi aminokwasami lizyny. Dlatego zdolność mikrosfer do przedłużenia, na przykład efekt hydroklurydu klodyniny, który jest przeciwnadciśnieniowy.
Mikrosfery podawano przez wstrzyknięcie podskórne z próbą albinasu i szczurów. Po wstrzyknięciu skurczowe ciśnienie krwi zmniejszało się przez dwie godziny, a następnie odzyskując swoją wartość podstawową. Analizowano tkaniny miejsca wstrzyknięcia i nie znaleziono mikrofad, chociaż zaobserwowano zapalenie.
W reakcjach prebiotycznych
W warunkach prebiotycznych - takich jak te, które powinny mieć prymitywną ziemię - formaldehyd mógł służyć do syntezy gliceraldehydu, chemicznego pośrednika zaangażowanego w procesy chemiczne, które mogłyby powstać życie.
Poprzednia hipoteza opiera się na fakcie, że zarówno glikoliza, jak i fotosynteza mają 3-fosforan gliceraldehydu jako metaboliczny.
Zaproponowano model chemiczny, który wyjaśnia biosyntezę gliceraldehydu z formaldehydu przez cykliczny szlak. Synteza gliceraldehydu ma miejsce przez dodanie formaldehydu do triosa (gliceraldehydu ↔ dihydroksyacetonu) z wytworzeniem tetrosa (↔ aldotrosa ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔ ↔.
Może ci służyć: erythriczne: cechy, struktura, funkcjeDodanie formaldehydu do glikaldehydu uzupełnia cykl. Występuje synteza dwóch cząsteczek triosa z sześciu cząsteczek formaldehydu.
Ogólnie rzecz biorąc, prebiotyczna synteza cukrów uważa się, że zaangażowana jest reakcja formozy, w której formaldehyd w obecności niewielkiej ilości glikaldehydu jest przekształcany w cukry przez aldoliczne reakcje kondensacyjne.
Zaproponowano, że utlenianie cukru prebiotycznego (glikaldehyd, trio, tetroze) wytwarzało polihydroksyasacidy, które działają jako substancje samozaparte.
Konwersja gliceraldehydu do kwasu mlekowego i kwasu glicerycznego, tlenku zależnego od wodorotlenku żelaza, wskazuje na oligoésteres tych hydroksyasików na powierzchni tego materiału.
Bibliografia
- Breslow, r., Ramalingam, v., Appaeee, c. 2013. Kataliza syntezy gliceraldehydu przez pierwotne lub wtórne aminokwasy w warunkach prebiotycznych funkcja pH. Ewolucja życia Pochodzenie biosfera. Doi 10.1007/S11084-013-9347-0.
- Carey, f. DO., Giuliano, r. M. 2016. Chemia organiczna. McGraw-Hill, Nowy Jork.
- Robyt, J.F. 1998. Niezbędne rzeczy chemii węglowodanów. Springer, Nowy Jork.
- Thornalley, s. 1., Wolff, s., Crabbe, J., Stern, a. 1984. Autoksydacja gliceraldehydu i innych prostych monosacharydów pod fizjologicznym katalizowanym przez bufor INS. Biochimica et Biophysica Acta, 797, 276-287.
- Vandelli, m.DO., Rivas, f., War, str., Forni, f., Arletti, r. 2001. Mikrosfery żelatyna usieciowana z D, L-gliceraldehydem jako potencjalnym systemem dostarczania daruga: przygotowanie, charakterystyka, in vitro i in vivo badania. International Journal of Pharmaceutics, 215, 175-184.
- Weber, a.L. 1987. Model Trose: gliceraldehyd jako źródło energii i monomerów do reakcji kondensacji prebiotycznej. Początki życia, 17, 107-19.

