Reguła Markovnikov
- 2118
- 151
- Herbert Wróblewski
Jaka jest zasada Markovnikova?
Reguła Markovnikov Jest to zasada empiryczna, sformułowana w 1869 r. Przez rosyjskiego chemika Vladimira Markovnikova, który służy do przewidywania regioselektywności produktów dodatku elektrofilowego. Nawet dzisiaj jest nadal obowiązujący, ujawniając swoją prostotę w tym, jak nadchodzi mechanizm kilku reakcji organicznych.
Ta zasada dotyczy szczególnie alken. Zatem pozwala przewidzieć, jakie będą produkty większościowe, gdy alkeny i alkyny reagują z HX (HF, HCL, HBR i HI).
 Uznanie zasady Markovnikova w hydrohalogenizacji propenu. Źródło: V8RIK, CC BY-SA 3.0, Via Wikimedia Commons
Uznanie zasady Markovnikova w hydrohalogenizacji propenu. Źródło: V8RIK, CC BY-SA 3.0, Via Wikimedia Commons Załóżmy, że na przykład hydrobromacja propenu lub propylenu (obraz doskonały). Reguła Markovnikov przewiduje, że produktem większościowym będzie ten, w którym atom bromowy jest powiązany z węglem centrum; Podczas gdy w drobnym produkcie brom kończy się na węglowym podwójnym wiązaniu.
Należy zauważyć, że produkt większości ma atom wodoru powiązany z końcowym węglem. Ten ostatni punkt jest najłatwiejszy do zapamiętania: wodór HX idzie do węgla podwójnego wiązania, które ma więcej wiązań wodoru lub C-H.
Zasady Reguła Markovnikov
Dodatek elektrofilowy
Do podwójnych wiązań alkenów lub alkin. HX ma zły atom elektronów, czyli H, i atom bogaty w elektrony, czyli x.
Dlatego Hx może być reprezentowany jako Hδ+-Xδ-, będąc regionem Hδ+ podatne na odbieranie elektronów, w tym przypadku podwójne wiązanie alkenu, ma miejsce w ataku elektrofilicznym (patrz zdjęcie poniżej).
Może ci służyć: kwas fenylooctowy: struktura, właściwości, zastosowania, efektyStabilność karbokacji
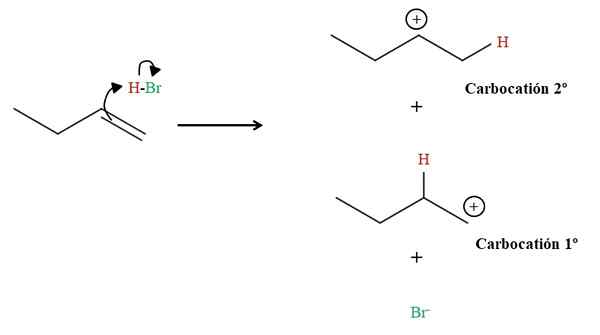
 Tworzenie dwóch karbokacji w hidrobromacji 1-butenu. Źródło: Gabriel Bolívar przez Molview.
Tworzenie dwóch karbokacji w hidrobromacji 1-butenu. Źródło: Gabriel Bolívar przez Molview. Jak widać powyżej, 1-butenowe podwójne wiązanie atakuje wodór HBO. W ten sposób elektrony wiązania H-BR „Otwórz” w kierunku atomu bromu, tworząc karbokacja i anion BR-. Istnieje jednak możliwość utworzenia dwóch karbokacji: jednej pierwotnej (1st) i drugiego wtórnego (2.).
Każda karbokacja jest związkiem pośredniego, z którego wyprowadzi produkt końcowy. Gdy pojawią się dwie karbokacje, będziemy mieć dwa produkty: 2-bromobutano i 1-bromobutano. Br- Działa jak nukleofile atakujące jedną z dwóch karbokacji:
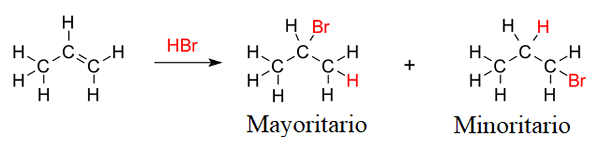
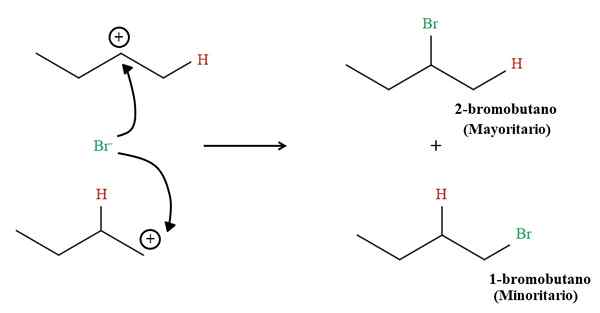 1-butenowe produkty hydrobromacyjne. Źródło: Gabriel Bolívar przez Molview.
1-butenowe produkty hydrobromacyjne. Źródło: Gabriel Bolívar przez Molview. Ale odsetek obu produktów nie wynosi 50%; 2-bromobutano występuje znacznie większe niż 1-bromobutan.
Powodem jest to, że 2. karbokacja jest bardziej stabilna niż 1. karbokacja, ponieważ jego dodatnie obciążenie jest lepiej stabilizowane przez sąsiednie atomy węgla; Podczas gdy w karbokacji 1 atom wodoru nie przyczynia się prawie żadnej gęstości elektronicznej w tym dodatnim obciążeniu (do indukcji lub hiperkonjugacji).
Bogaci stają się bogatsi
Reguła Markovnikova narodziła się z końcowych obserwacji, a od nich mechanizmy zilustrowane powyżej można je rozważyć, aby je wyjaśnić.
Bez potrzeby zawsze wychwytywania tych mechanizmów lub odliczenia stabilności karbokacji pośrednie. Zatem najbardziej uwodorniony węgiel staje się jeszcze bardziej uwodorniony.
Może ci służyć: jakie są anomalie wodne?Z drugiej strony atom X, w tym przypadku BR, kończy się węglem podwójnego wiązania, które ma więcej wiązań C-C lub bardziej zastąpione innymi atomami, które nie są wodorem. Ponieważ w 1-butenu jego końcowy węgiel jest = cho2, To ten, który otrzymuje wodór, aby przekształcić się w grupę -ch3.
Przykłady
Przypadek reguły Markovnikov zastosowano w reakcji hydrobromacji. Jest również ważny do reakcji hydrokloklinowania, hydroiodacji, hydroaminacji i hydratacji, albo dla alkenów lub alkin.
W poniższej sekcji niektóre dodatkowe przykłady będą postrzegane jako ćwiczenia.
Rozwiązane ćwiczenia
Ćwiczenie 1
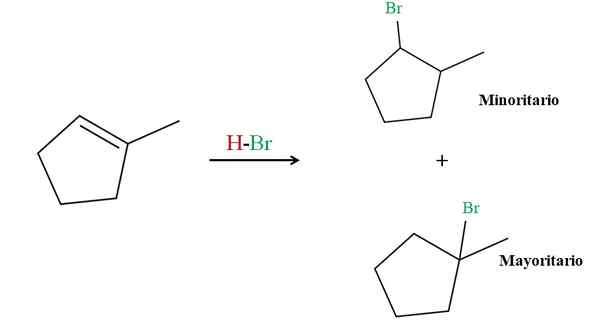 Hydrobromacja 2-metylocyklopentenu. Źródło: Gabriel Bolívar przez Molview.
Hydrobromacja 2-metylocyklopentenu. Źródło: Gabriel Bolívar przez Molview. Reguła Markovnikov twierdzi, że HBR H dla górnej reakcji musi przejść do węgla podwójnego wiązania z większą liczbą atomów wodoru. W tym przypadku odpowiada wyżej węglowi, ponieważ węgiel po prawej stronie, powiązany z Cho3, Nie ma nawet atomów wodoru.
Zatem wodór HBR idzie do węgla powyżej, podczas gdy BR kończy się połączonym z węglem po prawej (produkt większości). Z drugiej strony, jeśli wodór jest powiązany z węglem po prawej, BR jest skierowany do węgla powyżej (produkt mniejszy).
Należy zauważyć, że produkt większości składa się z trzeciego halogenku, bardziej stabilnego z definicji i efektów stabilizacji częściowych dodatnich obciążeń; Podczas gdy produkt mniejszościowy jest 2., mniej stabilny halogenk.
Oba produkty, większość i mniejsze. Ten rodzaj produktu mniejszościowego, wbrew zasadzie Markovnikova, jest znany jako produkt Antimarkovnikov.
Może Ci służyć: elektroda odniesienia: charakterystyka, funkcja, przykładyĆwiczenie 2
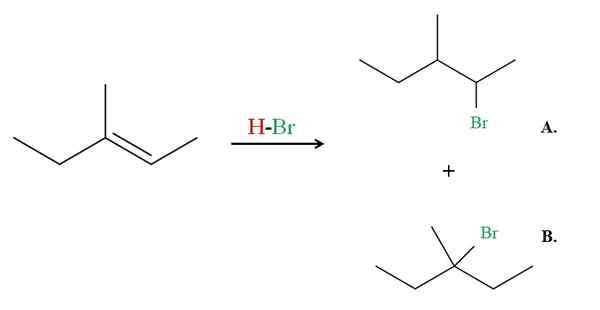 Hydrobromacja 3-metylo-2-pentenu. Źródło: Gabriel Bolívar przez Molview.
Hydrobromacja 3-metylo-2-pentenu. Źródło: Gabriel Bolívar przez Molview. Teraz zobacz przykład 3-metylo-2-pentenu.
Jeśli zaobserwowano, prawy węgiel podwójnego wiązania ma h, a ten po lewej stronie. Dlatego H HBR trafi do tego węgla, węgiel musi trafić do centrum, aby spowodować produkt B. Produkt B jest większością, ponieważ znowu jest to trzeci halogen, a produkt jest HALURO 2.
Ćwiczenie 3
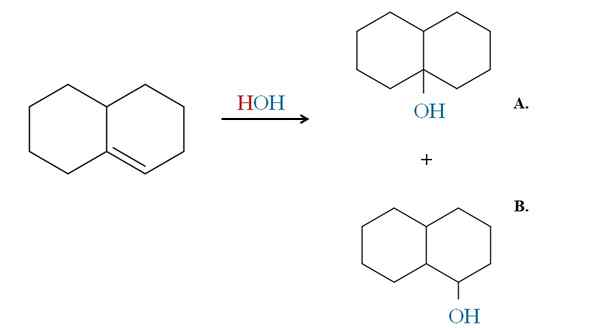 Przykład zasady Markovnikova w nawodnieniu cyklicznego alkenu. Źródło: Gabriel Bolívar przez Molview.
Przykład zasady Markovnikova w nawodnieniu cyklicznego alkenu. Źródło: Gabriel Bolívar przez Molview. Poprzednie przykłady wygenerowałyby te same produkty, gdyby zamiast HBR zostaną użyte HCL i HI. To samo jest tak samo jak w przypadku H2O W reakcji nawodnienia katalizowanej przez kwas i ciepło. Och, przychodzi, aby wymienić atom HX.
Dlatego zasada Markovnikova mówi nam, że w powyższym dodatku elektrofilowym OH przejdzie do węgla najczęściej zastąpionego podwójnego wiązania, z mniejszym wodorem.
Zatem produkt A jest większością, a produkt B mniejszość. Zwróć uwagę na to, że produkt A jest trzecim alkoholem, a produkt B A 2. alkohol.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Reguła Markovnikova. Źródło: w:.Wikipedia.org
- Steven a. Hardinger. (2017). Ilustrowany glosariusz chemii organicznej: zasada Markovnikova. Odzyskane z: chem.UCLA.Edu
- Gamini Gunawardena. (24 sierpnia 2020). Reguła Markovnikova. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Redaktorzy Enyclopaedia Britannica. (17 września 2013 r.). Reguła Markovnikova. Odzyskane z: Britannica.com
- Dr. S. Gevorg. (2020). Chemia organiczna: zasada Markovnikova z problemami praktykowymi. Odzyskane z: chemistroodss.com

