Ciepło spalania

- 5100
- 693
- Pani Gilbert Stolarczyk
Jakie jest ciepło spalania?
On Ciepło spalania Jest to energia uwalniana, gdy pewna ilość materiału, zwykle jedna mol, reaguje egzotermicznie z tlenem powietrza. Jest to niezbędna właściwość termochemii w charakterystyce paliw, alkoholi, a zwłaszcza węglowodorów, takich jak butan i metan.
Kiedy substancja spala światło i ciepło, energia, którą można użyć do pracy na innych ciałach. Na przykład wytwarzane ciepło jest w stanie podgrzewać duże objętości wody, których para dociska otoczenie, działając niektórym generatorom elektrycznym; Lub po prostu dalsze rozgrzewanie produktów na parze.
 Ciepło wytwarzane przez spalanie gazu kuchennego służy do podgrzewania kotłowni i żywności
Ciepło wytwarzane przez spalanie gazu kuchennego służy do podgrzewania kotłowni i żywności Ciepło spalania różni się między wszystkimi substancjami, mimo że jego chemiczny charakter jest w istocie taki sam. Ta zmiana odpowiada względnej stabilności, to znaczy: im bardziej niestabilny związek, tym większa uwalniana energia, reprezentowana jako -Hh. Symbol ujemny oznacza, że ciepło wypływa.
Różne wartości -Δh są używane do porównania względnej stabilności między różnym alkausem i ich izomerami. Pozwala również na stabilność.
Pomiar
Aby zmierzyć ciepło spalania, potrzebna jest pompa kalorymetryczna. W nim substancja reaguje z tlenem przez aktywację iskry elektrycznej.
Następnie uwalniane ciepło ogrzewa objętość wody otaczającej przedział próbki, mierząc temperaturę przed i po spalaniu, a także masę wody i paliwa.
Tak więc zwolniona energia będzie równa:
CEH2O·MH2Lub · δt
GdzieEH2O Jest to ciepło właściwe wody, 4.184 J/g · ºC, MH2Lub masa wody i δT jej zmiana temperatury. Wreszcie, to ciepło, wyrażone w jednostkach dżurowych lub kalorii, jest podzielone między masę lub mole paliwa umieszczonego wewnątrz pompy kalorymetrycznej, aby uzyskać ciepło spalania na jednostkę masy lub moli.
Może ci służyć: jaki jest mechaniczny odpowiednik ciepła?Metale się nie łączą, ale utleniają się przy różnych prędkościach w zależności od temperatury, w której są odsłonięte. Ciepło, które wytwarzają, jest nikczemne, aby mierzyć w taki sam sposób, jak odbywa się to z węglowodorami i innymi paliwami. Nie są zatem substancjami palnymi.
Potencjalne energie
Podczas spalania łącza są rozbite w celu tworzenia nowych, bardziej stabilnych. Energia zawarta we wszystkich powiązaniach cząsteczkowych jest niezależna od jej ruchu, więc istnieje energia potencjalna.
Im większa energia potencjalna, tym bardziej niestabilna będzie cząsteczka, a zatem uwolni więcej ciepła po ustaleniu nowych linków.
Aby wiedzieć, które dokładnie są te nowe linki, należy wziąć pod uwagę produkty kompletnego spalania: co2 W przypadku węgla, H2Lub dla wodoru, a nie2 Dla azotu. W odniesieniu do węglowodorów, ich całkowite spalanie wygeneruje stechiometryczne mieszanki CO2 i H2ALBO.
Obie cząsteczki, co2 i H2Lub mają bardzo niskie potencjalne energie, ponieważ ich linki (O = C = O i H-O-H) są bardzo stabilne w porównaniu z powiązaniami węglowodorowymi, z których pochodziły (C-H i C-C).
Stabilność względna
Potencjalne energie są swobodnie. Ale ich odmiany nie są, to znaczy różnica tych energii między produktami (CO2 i H2O) i reagenty (węglowodory).
Dlatego posiadanie tych wariantów lub co jest takie samo, ich ciepło spalania, możesz wiedzieć, jaka jest względna stabilność między zestawem węglowodorów lub izomerów.
Zamyka
Alkan mogą być liniowe, rozgałęzione lub cykliczne. W przypadku alkanów liniowych jego ciepło spalania zmienia się w zależności od długości jego łańcuchów; to znaczy zależy od liczby jednostek CH2 Posiadać. Rozważ przykład N-heksan, N-heptano i N-oktan:
Może ci służyć: jod: historia, właściwości, struktura, uzyskiwanie, ryzyko, użyciaCh3(Ch2)4Ch3, -ΔH = 4163 kJ/mol
Ch3(Ch2)5Ch3, -ΔH = 4817 kJ/mol
Ch3(Ch2)6Ch3, -ΔH = 5471 kJ/mol
Widać, że jego ciepła spalania różnią się o 654 kJ/mol. Oznacza to, że każdy cho2 który jest dodawany do łańcucha zwiększa ciepło spalania z prędkością 654 kJ/mol. Zatem nonano, ch3(Ch2)7Ch3, Będzie miał ciepło spalania równe 6125 kJ/mol (5471 kJ/mol + 654 kJ/mol).
To samo, co powiedzenie, że dłuższe łańcuchy mają większe potencjalne energie, a zatem są bardziej niestabilne.
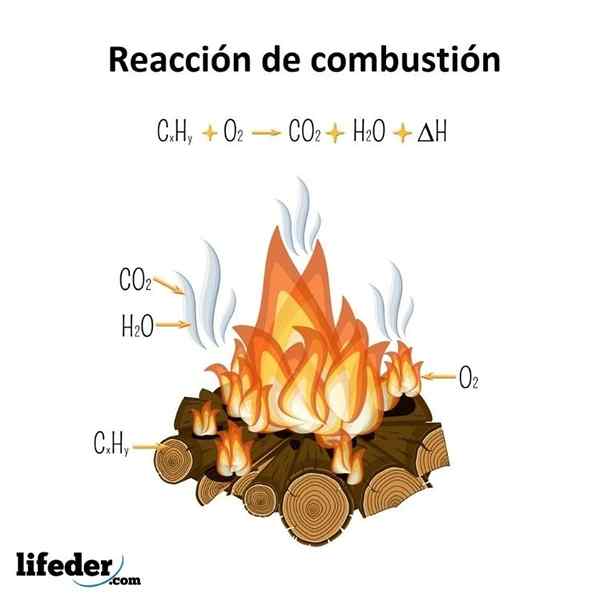
Basified Alkanes są bardziej stabilne niż liniowe, a to wywnioskowane jest z ich ciepła spalania. Rozważ teraz przypadek trzech izomerów oktanu:
 Ogrzewanie spalania dla trzech oktanowych izomerów. Źródło: Gabriel Bolívar przez Molview.
Ogrzewanie spalania dla trzech oktanowych izomerów. Źródło: Gabriel Bolívar przez Molview. On N-Octano jest najbardziej niestabilne, ponieważ jego ciepło spalania jest największe (5471 kJ/mol). Z drugiej strony izomery 2-metyloheptano i 2,2-dimetyloheksanu. 2,2-dimetyloheksan jest najbardziej stabilny dla bycia najbardziej rozgałęzionym z trzech izomerów.
Alkeny
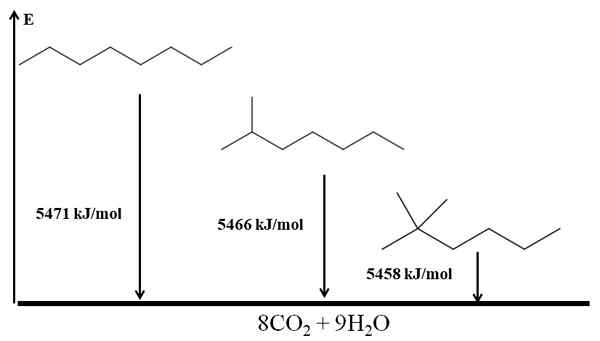
Względną stabilność alkenów można również uzyskać z ich ciepła spalania. Rozważmy na przykład cztery izomery Butenus:
 Spalanie ciepła dla izomerów Buteno. Źródło: Gabriel Bolívar przez Molview.
Spalanie ciepła dla izomerów Buteno. Źródło: Gabriel Bolívar przez Molview. Tutaj nie mówimy już o konsekwencjach, ale o stopniu wymiany podwójnego wiązania, C = C i jego napięć van der Waalsa; to znaczy odpychania elektroniczne i steryczne między dwiema grupami zlokalizowanymi po tej samej stronie podwójnego wiązania.
Pierwszy izomer, 1-buten, jest najbardziej niestabilny, ponieważ jego podwójne wiązanie jest mniej zastąpione (h (h2C = c). Znajduje to odzwierciedlenie w cieple spalania 2717 kJ/mol.
Może ci służyć: kwas chlorogenowyPo prawej, cis-2-buten, jest nieco bardziej stabilny, ponieważ jego podwójne wiązanie jest bardziej wymienione. Ale Trans-2-buten jest jeszcze bardziej, ponieważ nawet jeśli ma ten sam stopień substytucji, grupy Choons3 podwójnego wiązania są w pozycjach trans, to znaczy po różnych stronach podwójnego wiązania. Należy zauważyć, że ciepło trans-2-butenu (2707 kJ/mol) jest zaledwie nieco niższe niż ciepło cis-2-buten (2710 kJ/mol).
Ostatni izomer, 2-metylo-2-buten, który jest również w równym stopniu zastępowany jako CIS i Trans 2 Bungeo, jest jednak najbardziej niestabilny ze wszystkich. To dlatego, że oba CH3 Znajdują się w jednym z węgli podwójnej więzi, a zatem będąc alkenem z Cho3 Geminals.
Związki karbonylowe
A także ogólnie alkos i inne węglowodory, względna stabilność związków karbonylowych (ketony, aldehydy, kwasy karboksylowe) są również związane z ich cieplami spalania.
Zatem bardziej stabilizowane lub mniej reaktywne ich grupy c = o, nieletni będą ich cieplami spalania.
Na przykład ciepło spalania butanalskiego, CH3Ch2Ch2Cho, to 2475 kJ/mol. To ciepło jest wyższe niż 2-butanon, ch3Ch2Coch3, który jest równy 2442 kJ/mol. Dlatego Butanal jest bardziej niestabilny niż 2-butanon.
W 2-butanonie c = o jest bardziej stabilizowany dzięki grupom CH3Ch2 i rozdz3; Rzecz, która nie dzieje się z Butanem, gdzie jedna z grup jest zaledwie atomem h.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Ciepło spalania. Źródło: w:.Wikipedia.org
- Fundacja CK-12. Ciepło spalania. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- BBC. (2020). Energia chemiczna: entalpia spalania. Źródło: BBC.współ.Wielka Brytania
- Steven a. Hardinger. (2017). Ilustrowany glosariusz chemii organicznej: entalpia spalania. Odzyskane z: chem.UCLA.Edu

