Radio struktury, właściwości, użycia, uzyskiwanie
- 738
- 172
- Eugenia Czapla
On radio Jest to element metaliczny należący do grupy 2 stolika okresowego, metali alkalicznych, których symbolem chemicznym jest RA. Jest to ostatni członek tej grupy, znajdujący się pod barem, i poprzedzający pierwiastki radioaktywne, takie jak tor i uran; Jednak promień jest około miliona razy bardziej radioaktywny, a zatem bardziej niebezpieczny niż sam uran.
Jest to element otoczony niesamowitymi i niefortunnymi historiami, wszystko w wyniku ignorancji jej negatywnego wpływu na zdrowie. Niebieskawo jasność ich soli i roztworów wodnych urzekali naukowcy Pierre i Marie Curie, którzy odkryli to w 1898 r. Analizując niewytłumaczalne i silne promieniowanie z próbek rudy Pechblenda, do których ich zawartość uranu i uranu usunęła ich zawartość uranu i polon.
 Ilustracja Marie Curie, Discovener of the Radio
Ilustracja Marie Curie, Discovener of the Radio Wyeliminował uran i polon, curie i doszedł do wniosku, że w Pechblendzie był inny element, odpowiedzialny za silne promieniowanie, które pomysłowo może określić ilościowo. Ten nowy element był chemicznie bardzo podobny do baru; Jednak w przeciwieństwie do spektralnych zielonych linii, te były koloru karminu.
Zatem po przetworzeniu, oczyszczaniu i analizie ton Pechblenda, uzyskali 0.1 mg Racl2. Do tego czasu, w 1902 r., Zdecydowali już masę atomową radia, której nazwa pochodzi od łacińskiego słowa „promień”, co oznacza „ray”. Radio jest dosłownie promiennym elementem.
Osiem później, w 1910 r2 za pomocą rtęci. Urodziła się gorączka badawcza, która później stała się niepokojącym wrażeniem handlowym, kulturalnym i leczniczym.
[TOC]
Struktura
Radio to metal, którego atomy są bardzo nieporęczne. Konsekwencją tego jest to, że ich kryształy są mało gęste (choć nieco większe niż w Bario) i przyjmują strukturę sześcienną wyśrodkowaną na ciele (BCC). Z tej struktury żaden inny poziom nie zgłasza innych temperatur ani ciśnień.
Elektroniczna Konfiguracja

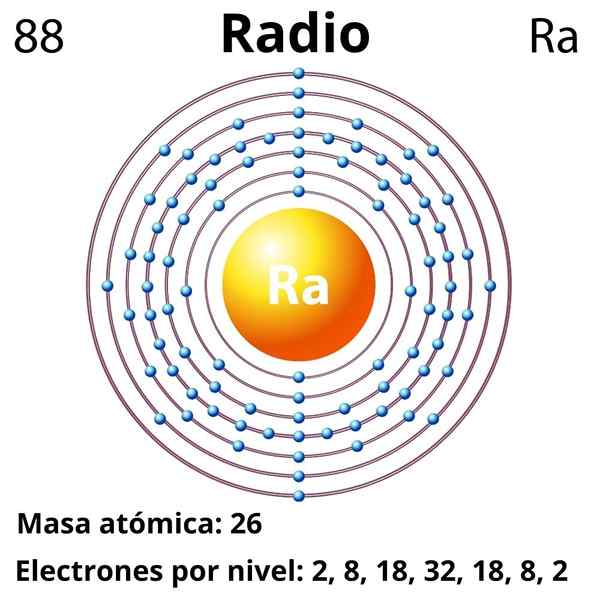
Konfiguracja elektroniczna dla radia jest następująca:
[Rn] 7s2
Z ogromną łatwością staje się kation RA2+, który jest izolektroniczny do szlachetnego gazu radonu. Dlatego wszystkie związki promienia zawierają kation Ra2+, ustanowienie głównie interakcji jonowych; Szacuje się jednak, że możliwe jest, że ze względu na efekty relatywistyczne może tworzyć powiązania z niezwykłym znakiem kowalencyjnym (RA-X).
Może ci służyć: Benzoat potasu: struktura, właściwości, uzyskiwanie, użyciaWłaściwości radiowe
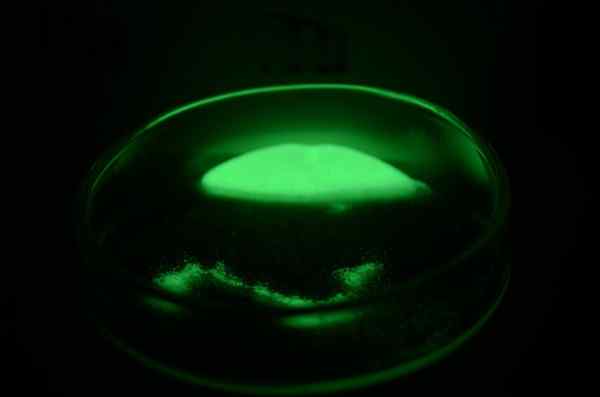 Próbka złożona radiowa
Próbka złożona radiowa Wygląd fizyczny
Radio to srebrny biały metal, który natychmiast farbuje żółty i ciemnieje podczas reakcji z azotem z powietrza, tworząc jego Nitrruro, RA3N2. Ponieważ jest tak trudny do manipulowania, istnieje niewiele cech fizycznych promienia, które zostały określone bezpośrednio.
Liczba atomowa
88
Masa cząsteczkowa
226.03 g/mol
Temperatura topnienia
Około 700 ° C. Ta wielkość nie była dokładnie określona.
Punkt wrzenia
Radio gotuje się między 1100 a 1700 ° C. Ten wielki margines niedokładności odzwierciedla ponownie powikłania manipulowania tak niestabilnym metalem.
Gęstość
5.5 g/cm3
Fusion Heat
8.5 kJ/mol
Ciepło parowe
113 kJ/mol
Stan utleniania
Radio ma pojedynczy stan utleniania +2.
Elektronialiczność
0.9. Ta wartość wiernie odpowiada silnym elektropozytywnym charakterze promienia.
Energie jonizacyjne
Po pierwsze: 509.3 kJ/mol
Drugi: 979 kJ/mol
Radioaktywność
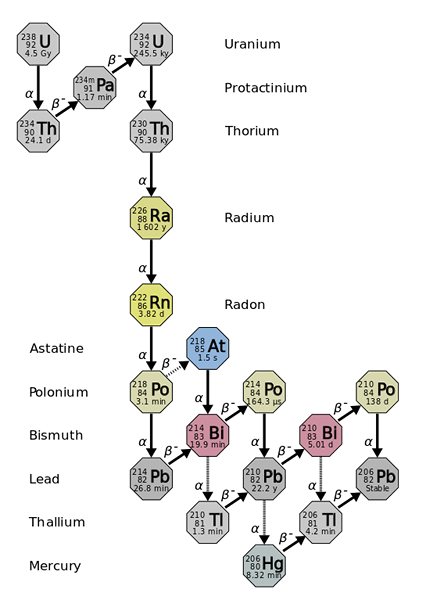 Promień wywodzi się z radioaktywnych spadków cięższych i bardziej niestabilnych elementów, jak w przypadku izotopu uranu-238. Źródło: Użytkownik: Tosaka, CC o 3.0, Via Wikimedia Commons
Promień wywodzi się z radioaktywnych spadków cięższych i bardziej niestabilnych elementów, jak w przypadku izotopu uranu-238. Źródło: Użytkownik: Tosaka, CC o 3.0, Via Wikimedia Commons Promień jest około miliona razy bardziej radioaktywny niż uran. Wynika to głównie z faktu, że wytwarzane są inne izotopy, takie jak 222RN (obraz doskonały), który z kolei rozpada się poprzez emitując cząstki α do przekształcenia w izotop 218PO. Próbka radiowa wydaje zatem duże ilości cząstek α i β-, a także promienie γ.
Na przykład gram radia cierpi 3.7 · 1010 Rozpad na sekundę, miara, która służyła do zdefiniowania jednostki CI, zwanej curie. Ta energia wystarczy, aby podgrzewać próbkę 25 gramów wody 1 ° C na godzinę.
Jeśli obserwuje się łańcuch rozpadu, okaże się, że początkowy izotop, 238U, masz T1/2 4.5 lat Giga (miliardy lat); zamiast tego, 226Ra ma T1/2 1600 lat, który również produkuje izotopy T1/2 zaledwie dni, minut i sekund.
Radioaktywność radia i jego związków jest jonizująca, więc substancje fluorescencyjne, nawet otaczające atomy, oświetlenie w nocy, stając się w stanie wywołać reakcje wybuchowe. Ta właściwość jest znana jako radioliminescencja.
Związki i reaktywność
Gdy sole lub związki radiowe są ogrzewane w lżejszym, strzelają, płomień karmin. Takie substancje stałe są zwykle białe lub bezbarwne, ale są barwione na żółty i na koniec przyciemniające w wyniku radioaktywności atomów radiowych. Jeśli mają zanieczyszczenia baru, mogą pokazać różowe tony.
Może ci służyć: reakcja podwójnego podstawieniaChemia radiowa jest bardzo podobna do chemii Bario, jakby byli dwoma nierozłącznymi braciami, Ra-ba. Obie tworzą te same sole, nierozpuszczalne w wodzie, z różnicą, że te z promienia są nieco bardziej nierozpuszczalne. Na przykład siarczan radiowy, satyna4, Jest bardziej nierozpuszczalny niż siarczan baru, Baso4; W rzeczywistości jest to najbardziej nierozpuszczalny siarczan, jaki kiedykolwiek znany: 2.1 mg z tego rozpuszcza się w 1 litrach wody.
Z drugiej strony wodorotlenek radiowy, RA (OH)2, Jest to najbardziej rozpuszczalny i podstawowy ze wszystkich wodorotlenków ich rówieśników.
W roztworze kation RA2+, Zamiast zachowywać się jak kwasy Lewisa, są one podstawowe, ponieważ ich duży rozmiar uniemożliwia cząsteczkom.
Analogia chemiczna między radiem a barem powraca do tego metalu trudno się oddzielić, ponieważ jego sole koprecitują z solami baru.
Radio używa/aplikacje
Świeciowe zegarki
 Zegarki świetlistych i fosforescencyjnych były bardzo pożądane w dziewiętnastym wieku, ze względu. Źródło: Broń95, CC BY-SA 3.0, Via Wikimedia Commons
Zegarki świetlistych i fosforescencyjnych były bardzo pożądane w dziewiętnastym wieku, ze względu. Źródło: Broń95, CC BY-SA 3.0, Via Wikimedia Commons Najpopularniejsze i kontrowersyjne użycie promienia miało być wykorzystywane jako dodatek do obrazów zegarków. Jego atomy zostały włączone do pastnych preparatów siarczku cynku, ZNS, które pochłaniały emisje radioaktywne w celu uwolnienia zielonego i fosforyzującego światła. Farba nałożono na ręce zegara (obraz doskonały).
Problem tego użycia polegał na ciągłej ekspozycji radioaktywnej, która wpłynęła na użytkowników tych zegarków; Lub gorzej, dla pracowników, którzy namalowali je w fabrykach.
W 1924 r. Kilku pracowników, którzy pracowali w branży farb, znanych później jako Radio Girls (Radium Girl w stanie nakładać farbę radioaktywną na zegary.
To, a także ignorancja promienia i niewielka etyka nie nakładania środków ochrony, które gwarantowały bezpieczeństwo pracowników, zakończyła się skandalem prawnym, który zrewolucjonizował prawa bezpieczeństwa zawodowego.
Może ci służyć: wynajem halogenurus: właściwości, uzyskiwanie przykładówObrazy radiowe przestały wytwarzać w 1960 roku; Chociaż dzisiaj istnieje kilka kolekcjonerskich okazów, które mają go na swoich powierzchniach.
Radithor
 Butelka Radithor wystawiana w National Museum of Nuclear Science and History w Nowym Meksyku. Źródło: Sam Larussa ze Stanów Zjednoczonych Ameryki, CC BY-SA 2.0, Via Wikimedia Commons
Butelka Radithor wystawiana w National Museum of Nuclear Science and History w Nowym Meksyku. Źródło: Sam Larussa ze Stanów Zjednoczonych Ameryki, CC BY-SA 2.0, Via Wikimedia Commons Radithor był jednym z wielu produktów farmaceutycznych i kosmetycznych, które ogłosiły wydajność radiową do walki z tysiącem i jednym chorym. Zawierał mikrometryczną ilość radia, która jako powinna leczyć wszystkie choroby trawienne i hormonalne. Jednak w 1932 r., Po śmierci Eden Byersa, jednego z jego najbardziej żarliwych konsumentów, radithor opuścił rynek.
Radioterapia
Nie wszystkie zastosowania radiowe były sensacyjne, pseudonaukowe i pozbawione skrupułów (lub przestępców). Były też naprawdę korzystne dla zdrowia, przynajmniej do pewnego czasu. Sole radiowe, Racl2 i Rab2, Są one stosowane w leczeniu raka, w szczególności raka kości.
Izotop 223RA, gdy jest zdezorientowany jonami wapnia w metabolizmie, kończy się niszczeniem komórek rakowych zlokalizowanych w kości.
Jednak wiele terapeutycznych zastosowań promienia zostało zastąpionych bezpieczniejszymi, ekonomicznymi i wydajnymi izotopami, takimi jak 60Co i 137Cs.
Uzyskanie
Radio jest jednym z elementów, których produkcja jest rzadka: około 100 gramów rocznie na całym świecie. Tony pomarańczowej uranu, takie jak ruda Pechblenda (lub uraninitu), są przetwarzane zgodnie z metodą Curie, która polega na leczeniu próbek wodorotlenkiem sodu, kwasem sodowym, kwasem sodowym i węglanem sodu, tak że mieszanka radia i siarczanów barowych, satynowej, satynowej, satynowej4-Baso4.
Satynowa mieszanka4-Baso4 Został przekształcony w ich odpowiednie chlorki, Racl2-Bacl2, Oddzielenie kationów RA2+ przez frakcjonalne krystalizacje i wreszcie oczyszczanie technik chromatografii jonowej. Racl2 Jest zmniejszony przez elektrolizę lub zmniejsza ją z metalowym aluminium do 1200 ° C.
Izotopy
Wszystkie izotopy radiowe są radioaktywne. Cztery z nich istnieją w naturze jako produkty radioaktywnego rozkładu atomów 232Th, 235U i 238LUB.
Te cztery izotopy to: 223RA (T1/2= 11.4 dni), 224RA (T1/2= 3.64 dni), 226RA (T1/2= 1600 lat) i 228RA (5.75 lat). Oczywiście prawie wszystkie atomy radiowe składają się z mieszanin izotopowych 226Ra i 228RA, ponieważ inni szybko się rozpadają.
On 226Ra jest najbardziej stabilnym ze wszystkich izotopów radia, wszystkie inne są zbyt niestabilne T1/2 Mniej niż dwie godziny.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Rad. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (2020). Rad. Odzyskane z: Britannica.com
- Radioaktywność. (S.F.). Radium: jądro radioaktywne, które tworzyły historię. Odzyskane: radioaktywność.UE.com
- Cantrill, v. (2018). Realia radu. Nature Chem 10, 898. doi.Org/10.1038/S41557-018-0114-8
- Elsevier b.V. (2020). Rad. Scientedirect. Pobrano z: Scientedirect.com
- « Czynniki erozji wiatru, typy, konsekwencje, przykłady
- Geografia Półwyspu Kursycznego, kraje, flora, fauna, klimat »

