Jaki jest proces izotermiczny? (Przykłady, ćwiczenia)

- 2354
- 294
- Pani Gilbert Stolarczyk
On proces izotermiczny lub izoterma jest odwracalnym procesem termodynamicznym, w którym temperatura pozostaje stała. W gazie są sytuacje, w których zmiana w układzie nie powoduje różnic temperatury, ale cech fizycznych.
Zmiany te są zmianami fazowymi, gdy substancja zmienia się z stałego na ciecz, płynu gazowego lub odwrotnie. W takich przypadkach cząsteczki substancji dostosowują ich pozycję, dodając lub wydobywając energię cieplną.
 Rysunek 1. Carambanie, którzy topią się, są przykładem procesu izotermicznego. Źródło: Pixabay.
Rysunek 1. Carambanie, którzy topią się, są przykładem procesu izotermicznego. Źródło: Pixabay. Energia cieplna niezbędna do zmiany fazowej w substancji nazywa się ciepłem utajonym lub transformacyjnym.
Jednym ze sposobów uzyskania procesu izotermicznego jest skontaktowanie się z substancją, która będzie badanym systemem z zewnętrznym depozytem termicznym, który jest kolejnym systemem dużych kalorii pojemności. W ten sposób występuje taka powolna wymiana ciepła, że temperatura pozostaje stała.
Tego rodzaju procesy są często podawane w naturze. Na przykład u ludzi, gdy temperatura ciała wzrasta lub schodzi, czujemy się chorymi, ponieważ w naszym ciele liczne reakcje chemiczne, które utrzymują życie w stałej temperaturze. Jest to ważne dla gorącej krwi ogólnie.
Inne przykłady to lód, który topi się ciepłem, gdy przybywają wiosna i lód.
[TOC]
Przykłady procesów izotermicznych
-Metabolizm zwierząt o gorącym blasku odbywa się w stałej temperaturze.
 Rysunek 2. Zwierzęta o gorących zabawy mają mechanizmy utrzymywania stałej temperatury. Źródło: Wikimedia Commons.
Rysunek 2. Zwierzęta o gorących zabawy mają mechanizmy utrzymywania stałej temperatury. Źródło: Wikimedia Commons. -Gdy woda zagotuje się, występuje zmiana fazowa, płynu gazowego, a temperatura pozostaje stała w około 100 ° C, ponieważ inne czynniki mogą wpływać na wartość.
-Lód, który się topi, jest kolejnym częstym procesem izotermicznym, a także umieszcza wodę w zamrażarce, aby zrobić kostki lodu.
Może ci służyć: optyka geometryczna: jakie badania, prawa, zastosowania, ćwiczenia-Silniki samochodowe, lodówki, a także wiele innych rodzajów maszyn, działają poprawnie w określonym zakresie temperatur. Aby utrzymać odpowiednią temperaturę, urządzenia nazywane Termostaty. W swoim projekcie stosuje się różne zasady działania.
Cykl Carnota
Silnik Carnot to idealna maszyna, z której prace są uzyskiwane dzięki całkowicie odwracalnym procesom. Jest to idealna maszyna, ponieważ nie uwzględnia procesów, które rozpraszają energię, jako lepkość substancji, która wykonuje zadanie, ani tarcie.
Cykl Carnota składa się z czterech etapów, z których dwa są dokładnie izotermiczne, a pozostałe dwa adiabatyczne. Izotermiczne etapy to kompresja i ekspansja gazu odpowiedzialnego za tworzenie użytecznej pracy.
Silnik samochodowy działa z podobnymi zasadami. Ruch tłoka wewnątrz cylindra jest przekazywany do innych części samochodu i wytwarza ruch. Nie ma zachowania idealnego systemu, takiego jak silnik Carnot, ale zasady termodynamiczne są powszechne.
Obliczanie pracy wykonanej w procesie izotermicznym
Aby obliczyć pracę wykonaną przez system, gdy temperatura jest stała, należy zastosować pierwsze prawo termodynamiki, które stwierdza:
Δu = q - w
To inny sposób wyrażania zachowania energii w systemie, przedstawionym Δu lub zmiana energii, Q jak ciepło dostarczało i wreszcie W, która jest pracą wykonaną przez wspomniany system.
Załóżmy, że dany system jest idealnym gazem zawartym w cylindrze tłoka mobilnego DO, Co działa, gdy jego objętość V zmiana V1 Do V2.
 Rysunek 3. W procesie izotermicznym gaz rozszerza się w tłoku bez zmiany temperatury. Źródło: YouTube.
Rysunek 3. W procesie izotermicznym gaz rozszerza się w tłoku bez zmiany temperatury. Źródło: YouTube. Idealne równanie stanu gazu jest PV = NRT, który dotyczy objętości do ciśnienia P i temperatura T. Wartości n i r są stałe: n to liczba moli gazu i r stała gazu. W przypadku procesu izotermicznego produkt PV To jest stałe.
Może ci służyć: stałe antoine: wzory, równania, przykładyCóż, wykonana praca jest obliczana poprzez zintegrowanie małej pracy różnicowej, w której siła F wytwarza małe przemieszczenie DX:
Dw = fdx = padx
Jak ADX jest dokładnie zmiennością objętości DV, Więc:
DW = PDV
Aby uzyskać całkowitą pracę w procesie izotermicznym, wyrażenie DW jest zintegrowane:
Presja P i objętość V Są wykresami na schemacie P-v Jak pokazana na rysunku i wykonana praca jest równoważna obszarowi pod krzywą:
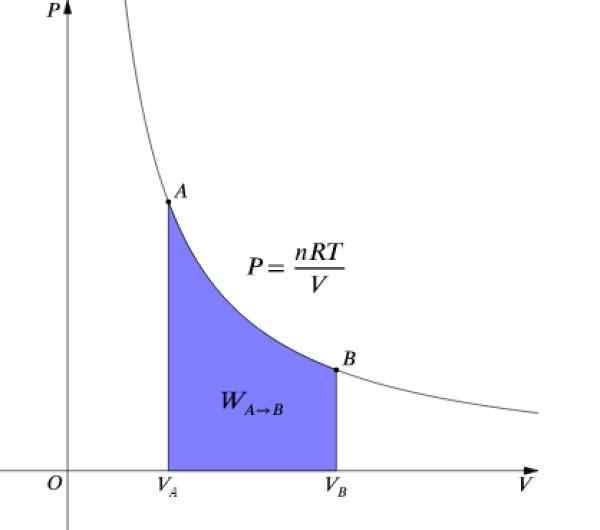 Rysunek 4. Schemat P-V procesu izotermicznego. Źródło: Wikimedia Commons.
Rysunek 4. Schemat P-V procesu izotermicznego. Źródło: Wikimedia Commons. Jak Δu = 0 Ponieważ temperatura pozostaje stała, w procesie izotermicznym musi:
Q = w
- Ćwiczenie 1
Cylinder wyposażony w mobilny tłok zawiera idealny gaz w temperaturze 127 ° C. Jeśli tłok porusza się do momentu zmniejszenia początkowej objętości 10 razy, utrzymując stałą temperatury, znajdź ilość moli zawartych w cylindrze, jeśli praca wykonana na gazie wynosi 38.180 J.
Fakt: R = 8.3 j/mol. K
Rozwiązanie
Stwierdzenie potwierdza, że temperatura pozostaje stała, a następnie jesteśmy w obecności procesu izotermicznego. Do pracy wykonanej na gazie masz wcześniej odliczone równanie:

127 ° C = 127 + 273 K = 400 K
N jasne, liczba moli:
N = w / rt ln (v2 / v1) = -38180 J / 8.3 j/mol.K x 400 k x ln (v2/10 V2) = 5 moli
Znak negatywny był przed pracą. Uważny czytelnik zauważy w poprzedniej części, że W został zdefiniowany jako „praca wykonana przez system” i ma znak +. Tak więc „praca wykonana w systemie” ma znak ujemny.
Może ci służyć: Druga równowaga Warunek: wyjaśnienie, przykłady, ćwiczenia- Ćwiczenie 2
Masz powietrze w cylindrze dostarczonym z tłokiem. Początkowo jest 0.4 m3 ciśnienia w temperaturze 100 kPa i 80 ° C. Powietrze jest ściśnięte na 0.1 m3 upewniając się, że temperatura wewnątrz cylindra pozostaje stała podczas procesu.
Określ, ile pracy jest wykonywana podczas tego procesu.
Rozwiązanie
Używamy równania do wcześniej odliczonej pracy, ale liczba moli jest nieznana, co można obliczyć za pomocą równania gazów idealnych:
80 ° C = 80 + 273 K = 353 K.
P1V1 = n.R.T → N = P1V1 /Rt = 100000 pa x 0.4 m3 /8.3 j/mol. K x 353 k = 13.65 mol
W = n.R.T ln (v2/V1) = 13.65 mol x 8.3 j/mol. K x 353 k x ln (0.1/0.4) = -55.442.26 J
Ponownie znak ujemny wskazuje, że praca została wykonana w systemie, co zawsze dzieje się, gdy gaz jest sprężany.
Bibliografia
- Bauer, w. 2011. Fizyka inżynierii i nauki. Tom 1. MC Graw Hill.
- Cengel i. 2012. Termodynamika. 7mama Wydanie. McGraw Hill.
- Figueroa, zm. (2005). Seria: Fizyka nauk i inżynierii. Tom 4. Płyny i termodynamika. Pod redakcją Douglas Figueroa (USB).
- Knight, r. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne.
- Serway, r., Vulle, c. 2011. Podstawy fizyki. 9na Cengage Learning.
- Wikipedia. Proces izotermiczny. Źródło: w:.Wikipedia.org.
- « Struktura akrylonitrylowa, właściwości, produkcja, zastosowania
- Kolejne zdania, jakie są i 75 przykładów »


