Struktura akrylonitrylowa, właściwości, produkcja, zastosowania

- 3962
- 725
- Eugenia Czapla
On Akrilonitryl Jest to związek organiczny, którego skondensowana formuła to Cho2Chcn. Jest to jeden z najprostszych istotnych nitryle. Chemia i strukturalnie jest to nic więcej niż produkt związku między grupą winylową, Cho2= CH- i grupa nitrylowa, cyjanku, C≡N. Jest to substancja o wielkim wpływie przemysłowym na świat tworzyw sztucznych.
Fizycznie jest to bezbarwny płyn z pewnym zapachem cebuli, a w stanie nieczystym przedstawia żółtawe tony. Jest wysoce łatwopalny, toksyczny i prawdopodobnie rakotwórczy, więc jest klasyfikowany jako niezwykle niebezpieczna substancja. Jak na ironię, wraz z nim są produkowane tworzywa sztuczne i zabawki codziennego życia, takie jak bloki Tupperware i Lego.
 Polimery akrylonitrylowe są obecne w plastiku Tupperware. Źródło: Stebulus przez Wikipedia.
Polimery akrylonitrylowe są obecne w plastiku Tupperware. Źródło: Stebulus przez Wikipedia. W skali przemysłowej, Acrilonitril. Prawie cała wyprodukowana ilość jest przeznaczona do produkcji tworzyw sztucznych, na podstawie homopolimerów, takich jak poliakrylonitryl lub w kopolimerach, takich jak akrylonitryl-butadien-styren.
[TOC]
Struktura akrylonitrylowa
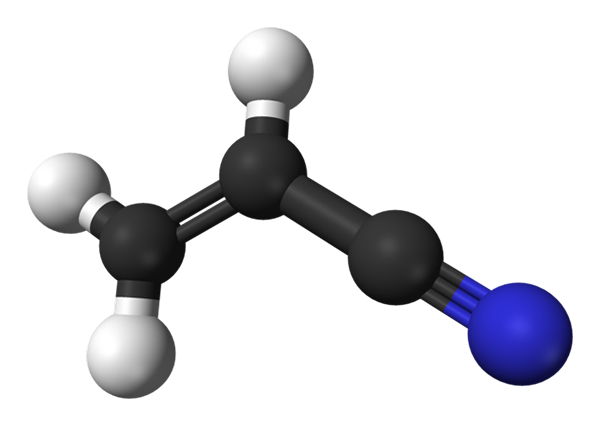 Struktura molekularna akrylonitrylu. Źródło: Benjah-BMM27 / Public Domena
Struktura molekularna akrylonitrylu. Źródło: Benjah-BMM27 / Public Domena Na górnym obrazie mamy cząsteczkę akrylitrylową reprezentowaną z modelem sfer i prętów. Czarne kule odpowiadają atomom węgla, podczas gdy białe i niebieskie odpowiednio atomy wodoru i azotu. Po lewej, ch2= CH- odpowiada grupie winylowej i prawej grupie cyjanowej, C≡N.
Cała cząsteczka jest płaska, ponieważ węgle grupy winylowej mają hybrydyzację SP2. Tymczasem węgiel grupy ciano ma hybrydyzację SP, znajdującą się obok atomu azotu w linii, która spoczywa na tej samej płaszczyźnie co reszta cząsteczki.
Grupa CN przyczynia się do polarności do cząsteczki, więc cząsteczka cho2CHCN ustanawia stały dipol, w którym najwyższa gęstość elektroniczna jest skierowana w kierunku atomu azotu. Dlatego dipol-dipol.
Może ci służyć: jaka jest okresowość chemiczna?Cząsteczki ch2CHCN są płaskie, mogą oczekiwać, że w swoich kryształach (zestalone w -84 °.
Nieruchomości
Wygląd fizyczny
Bezbarwny płyn, ale z żółtawymi tonami, gdy przedstawia zanieczyszczenia. Kiedy tak zalecają destylację go przed jego użyciem. Jest niestabilny, a także ma intensywny zapach podobny do cebuli.
Masa cząsteczkowa
53 064 g/mol
Temperatura topnienia
-84 ° C
Punkt wrzenia
77 ° C
Punkt flash
-5 ° C (zamknięty kubek)
0 ºC (otwarty kubek)
Temperatura samo -kierunkowego
481 ° C
Gęstość
0,81 g/cm3
Gęstość pary
1,83 w relacji powietrznej.
Ciśnienie pary
109 mmHg w 25 ° C
Rozpuszczalność
W wodzie ma rozpuszczalność od 74 g/l do 25 ° C. Akrilonitryl jest również znacznie rozpuszczalny w acetonie, oleju, etanolu, octanie etylu i etanilu benzenowym.
Rozkład
Gdy termicznie uwalnia toksyczny cyjankowy, tlenki węglowe i tlenki azotu.
Produkcja
Proces Sohio
Akryonitryl może wystąpić w masywnych skalach poprzez liczne reakcje i procesy chemiczne. Ze wszystkich z nich proces Sohio jest najczęściej używany, który składa się z katalitycznego amaksacacji propylenu. W reaktorze złoża fluidalnym propylen miesza się z powietrzem i amoniakiem w temperaturze około 400 i 510 °.
Reaganty wchodzą raz do reaktora, ma następującą reakcję:
2ch3−ch = ch2 + 2 NH3 + 3 o2 → 2 Ch2= CH-C≡N + 6 H2ALBO
Należy zauważyć, że tlen jest zredukowany do wody, podczas gdy propylen utlenia akrylonitryl. Stąd nazwa „amoidation”, ponieważ jest to utlenianie, które obejmuje udział amoniaku.
Może ci służyć: gotowanie: koncepcja, typy i przykładyAlternatywne procesy
Oprócz procesu Sohio można wymienić inne reakcje, które umożliwiają uzyskanie akrylonitrylu. Oczywiście nie wszystkie z nich są skalowalne, a przynajmniej w wystarczający opłacalny sposób, ani nie generują produktów o wysokiej wydajności lub czystości.
Akrylonitryl jest syntetyzowany, ponownie z propylenu, ale reaguje go z tlenkiem azotu na katalizatorach PBO2-Zro2 Airgel w kształcie. Reakcja jest następująca:
4 Ch3−ch = ch2 + 6 nr → 4 Cho2= CH-C≡N + 6 H2Lub + n2
Reakcja, która nie obejmuje propylenu, jest ta, która zaczyna się od tlenku etylenu, który reaguje z cyjankiem wodoru, aby przekształcić się w cyjanohydrynę etylenową; A później jest odwodniony w temperaturze 200 ° C w akrylonitrylu:
ETO + HCN → CH2Ohch2Cn
Ch2Ohch2CN + Q (200 ° C) → CH2= CH-C≡N +H2ALBO
Kolejną znacznie bardziej bezpośrednią reakcją jest dodanie cyjanoru wodoru na acetylen:
HC≡CH + HCN → CH2= CH-C≡N
Jednak powstaje wiele produktów wtórnych, więc jakość akrylonitrylu jest niższa w porównaniu z jakością procesu Sohio.
Oprócz wyżej wymienionych substancji, laktonitryl, propionitril.
Aplikacje
 Legos są produkowane głównie z plastikiem ABS, kopolimerem, w którym części. Źródło: Pxhere.
Legos są produkowane głównie z plastikiem ABS, kopolimerem, w którym części. Źródło: Pxhere. Acrilonitryl jest niezbędną substancją dla branży tworzyw sztucznych. Kilka jego pochodnych tworzyw sztucznych jest bardzo znanych. Tak jest w przypadku kopolimerów Acrilonitrilo-Butadiene-Steren. Mamy również włókna akrylowe, opracowane z homopolimerem poliakrylonitrylowym (PAN).
Może ci służyć: saponifikacjaWśród innych tworzyw sztucznych zawierających akrylonitryl jako monomer lub który zależy od niego dla jego produkcji, mamy: akrylenowy stretch (SAN), akrylonitryl butadienu (NBR), akrylan akrylonitrylowy (ASA), poliakryloamid.
Praktycznie każdy naturalny polimer, taki jak bawełna, można zmodyfikować, włączając jego struktury molekularne do akrylonitrylu. W ten sposób uzyskuje się pochodne nitrylowe, co czyni chemię bardzo szerokiego akrylonitrylu.
Jednym z jego zastosowań poza światem tworzyw sztucznych jest jak pestycydy zmieszane z tetrachlorkiem węglowym. Jednak ze względu na jego straszny wpływ na ekosystem morski, takie pestycydy zabroniły się lub podlegają silnym ograniczeniom.
Ryzyko
Akrilonitryl jest substancją niebezpieczną, więc należy ją zmanipulować z ekstremalną opieką. Wszelkie nieodpowiednie lub nadmiernie przedłużone narażenie na ten związek może być śmiertelne, albo przez inhalację, spożycie lub kontakt fizyczny.
Powinien być utrzymywany tak daleko, jak to możliwe od dowolnego źródła ciepła, ponieważ jest to lotna i bardzo łatwopalna ciecz. Nie powinien też mieć kontaktu z wodą, ponieważ reaguje z nią gwałtownie.
Oprócz tego jest to prawdopodobnie substancja rakotwórcza, która była związana z rakiem wątroby i płuc. Ci, którzy byli narażeni na tę substancję, mają wzrost poziomów ticyjanianu wydalonego w moczu i cyjanku krwi.
Bibliografia
- Morrison, r. T. i Boyd, R, N. (1987). Chemia organiczna. 5. edycja. Redakcja Addison-Wesley Inter-American.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10. edycja.). Wiley Plus.
- Wikipedia. (2020). Akrylonitryl. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Akrylonitryl. Baza danych Pubchem., CID = 7855. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Elsevier b.V. (2020). Akrylonitryl. Scientedirect. Pobrano z: Scientedirect.com
- Korry Barnes. (2020). Co to jest akrylonitryl? - Użyj i właściwości. Badanie. Odzyskane z: Study.com
- Pajonk, g.M., Manzalji, t. (1993). Synteza akrylonitrylu z mieszanin propylenowych i azotowych na PBO2-Zro2 Katalizatory airgel. Katalny Lett dwadzieścia jeden, 361-369. doi.Org/10.1007/BF00769488
- « Dynamiczne cechy programowania, przykład, zalety, wady
- Jaki jest proces izotermiczny? (Przykłady, ćwiczenia) »

