Podstawa testowa oksydazy, procedura i zastosowania
- 681
- 139
- Pani Gilbert Stolarczyk
Test oksydazy Jest to metoda diagnostyczna, która pokazuje obecność kompleksu enzymatycznego zwanego oksydazą cytochromu C. Ten układ indukuje transformację zredukowanego do utlenionego cytochromu, ponieważ oddaje tlen, a to z kolei działa jako ostatni akceptor elektronów (H. H+) W łańcuchu oddechowym.
Termin oksydazy jest podsumowującym sposobem odwoływania się do enzymu oksydazy cytochromu, znanego również jako oksydaza niefenol. W czasach starożytnych uważano, że enzymy oksydazy cytochromu i indeofenolu były dwoma różnymi enzymami, ale dziś wiadomo, że są takie same.
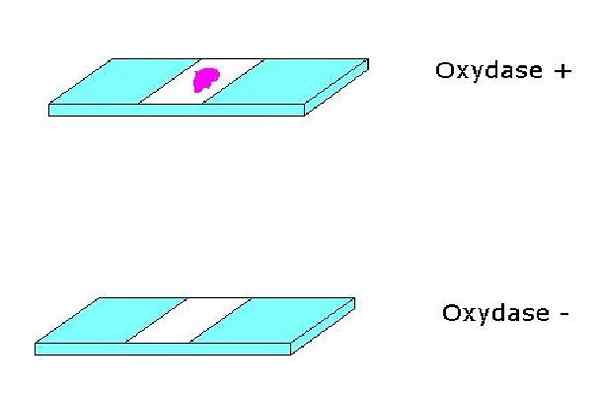
 Pozytywny i ujemny test oksydazy. Źródło: Brak, który można odczytać, nie dostarczył autora. Alfa.PROM ~ COMMONSWIKI Zakładano (na podstawie roszczeń dotyczących praw autorskich). [Domena publiczna]
Pozytywny i ujemny test oksydazy. Źródło: Brak, który można odczytać, nie dostarczył autora. Alfa.PROM ~ COMMONSWIKI Zakładano (na podstawie roszczeń dotyczących praw autorskich). [Domena publiczna] Ze swojej strony cytochromy to hemoproteiny zawierające żelazo i uzupełniają układ oksydazy cytochromu. Cytochromy mogą się różnić w zależności od gatunku do drugiego.
Istnieją różne odmiany cytochromów (cytochromy A1, A2, A3 i 0). Niektóre bakterie mogą wyprodukować tylko jedną, ale inne do dwóch lub trzech jednocześnie. W tym sensie obecność cytochromu A i A3 jest znana jako cytochrom - oksydaza C. Jest to rodzaj cytochromu, który wykrywa test oksydazy.
Gatunki Neisseria i Pseudomonas zawierają oksydazę Cytokroma C. Te gatunki dają pozytywny test oksydazy, pomagając odróżnić je odpowiednio od gatunków Acinetobacter i Stenotrofomonas.
Istnieją również inne gatunki, które są dodatnią oksydazą.
[TOC]
Podstawa
Charakterystyka układu oksydazy cytochromu C
System oksydazy Cychocroma C działa następująco: Mikroorganizmy pozytywne oksydazy wykorzystują tlen do generowania energii poprzez oddychanie tlenowe. Ten system działa dzięki transportowi elektronów z substancji dawcy, takich jak NADH+ W kierunku substancji przyjmujących, w tym przypadku tlenu.
Powoduje to energię (ATP) i nadtlenek wody, w zależności od układu cytochromu oksydazy, który ma mikroorganizm.
Właśnie dlatego większość dodatnich bakterii oksydazy jest również dodatnią katalazą, niezbędnym stanem do wyeliminowania nadtlenku wodoru, ponieważ ta substancja jest toksyczna dla bakterii.
Układ cytokromowy oksydazy C jest obecny w niektórych bakteriach aerobowych, niektórych opcjonalnych beztlenowych, rzadkich mikroaerofilowych i bez ścisłej beztlenowej. Ten ostatni jest zrozumiały, ponieważ ścisłe beztlewy nie mogą żyć w obecności tlenu, dlatego brakuje im układu oksydazy cytochromu.
Zasada dowodu
W tym teście użyj substancji, które działają jako sztuczne akceptory elektronów, zastępując tubylców w łańcuchu transportu elektronów.
Stosowane są głównie barwniki, takie jak parafenyloendiamina i indofenol, które działają jako podłoża receptorowe i darczyńców sztucznych elektronów.
Parafenyndiamina jest utleniona przez układ oksydazy cytokromowej C. Barwnik w jego zredukowanej postaci jest bezbarwny, ale w swojej utlenionej postaci jest kolorowy.
W ten sposób obecność systemu okledazy cytochromu C C; Cóż, pozytywna reakcja wygeneruje lawendę lub niebieskie zabarwienie -púrpura w zależności od zastosowanego odczynnika.
Może ci służyć: paleobiologia: historia, specjalności, odkryciaZ drugiej strony, jeśli ostatnia substancja akceptora elektronów w łańcuchu oddechowym różni się od tlenu, test oksydazy zapewni ujemne (nie ma produkcji kolorów); Tak jest w przypadku mikroorganizmów beztlenowych.
Podobnie, jeśli cytochrom stosowany przez mikroorganizm różni się od oksydazy cytochromu C, poda również test ujemny.
Procedura
W teście oksydazy istnieje kilka odczynników i protokołów, wszystkie w tym samym celu.
Odczynniki
Kovacs reacive, Gordon i McLeod Odczynnik, odczynnik Nadi, odczynnik stolarski, Suhrland i Morrison oraz stosowanie dysków oksydazy.
-Odczynnik oksydazy KOVACS
Składa się z tetrametylo-p-felendiaminy dichlorodatu na 1%.
Odczynnik KOVACS jest wytwarzany przez rozpuszczenie 1 GR substancji wymienionej w 50 ml wody destylowanej. Jest subtelnie podgrzewany, aż do całkowitego rozwiązania. Przenieś do bursztynu o wystarczającej pojemności i uzupełnij objętość przy 100 ml wodą destylowaną. Poczekaj co najmniej 15 minut przed użyciem. Zapisz w lodówce chronionej przed światłem.
Jest obracany jako odczynnik oksydazy Kovacs, aby odróżnić go od odczynnika Kovacs stosowanego do ujawnienia testu indolowego. Ten odczynnik jest najbardziej wrażliwy, mniej toksyczny, ale droższy niż reszta odczynników.
Pozytywna reakcja będzie dowodem. Udowodniona jest negatywna reakcja, ponieważ nie ma zmiany koloru w kolonii lub wymaga lekkiego różowego zabarwienia. Medium może również przyciemnić, ale to nie oznacza pozytywnej reakcji.
Z tym odczynnikiem czas reakcji jest kluczowy, ta zmiana koloru występująca od 5 do 15 sekund jest uważana za reakcję pozytywną.
-Gordon i McLeod Odczynnik
Składa się z dichlorodatu dimetylo-p-felendiaminy, znanego również jako N-dimetylo-p-felendiaminy lub p-amynodimetyloanilin. Jest przygotowywany zgodnie z opisem dla odczynnika oksydazy Kovacs, zastępując zaangażowaną substancję.
Ten odczynnik jest nieco bardziej stabilny niż odczynnik oksydazy Kovacs, chociaż wszystkie odczynniki zawierające p-penilendiaminy są niestabilne.
Ta reakcja jest spóźniona.
-Odczynnik Nadi
Składa się z 1% α-naftolu w alkoholu etylowym (95% etanolu) i 1%-limanylin. Mieszaninę jest przygotowywana w równych częściach i stosuje bezwzględny alkohol etylowy jako rozszerzenie, aż do zakończenia wystarczającej ilości przez 100 ml.
-Stolarka reaktywna, Suhrland i Morrison
Składa się z 1% p-amydimetyloalaniny szczawianu. Przygotuj się w ten sam sposób opisany dla odczynnika oksydazy KOVACS, zmieniając się dla odpowiedniej substancji.
Może ci podać: łańcuch pokarmowy dżungliPrzy gotowym rozwiązaniu przygotowuje się reaktywne paski w następujący sposób: Whatman 6-8 cm numer 1.
Mogą wysychać bez kontaktu z metalem, oszczędzaj nici słoiki z wysyłką i trzymaj w lodówce. Te paski są stabilne przez okres do 6 miesięcy.
Jest to najbardziej stabilny odczynnik ze wszystkich wymienionych, który jest w stanie przetrwać w roztworze do 6 miesięcy. Kolejną kwestią na korzyść jest to, że medium nie pokoloruje się wokół kolonii, jeśli jest używane bezpośrednio na płycie.
Wygląd czerwonego koloru jest interpretowany jako test pozytywny.
-Dyski oksydazy
Są to dyski komercyjne, które są impregnowane odczynnikiem do testu oksydazy. Na rynku jest kilka marek komercyjnych.
Jego zastosowanie jest dość praktyczne, ponieważ nie możemy przygotowywać świeżych odczynników, co ułatwia pracę. Uzyskane wyniki są wiarygodne, o ile dyski są odpowiednio zachowane.
Protokoły
Metoda płyty bezpośredniej, metoda pośrednia na papierze i stosowanie impregnowanych dysków z odczynnikami oksydazy.
-Metoda płyty bezpośredniej
2 lub 3 krople któregokolwiek z wyżej wymienionych odczynników dodaje się w tym celu bezpośrednio na kolonii zawartej na płycie pożywki hodowlanej, która nie zawiera glukozy.
Zmiana lub nie kolor kolonii jest interpretowana, a nie medium. Ważny czas reakcji zależy od zastosowanego odczynnika.
-Metoda pośrednia na papierze
Wytnij kawałek bibuły filtracyjnej (Whatman nr 1) do wielkości 6 cm2 I jest umieszczony w pustym Petriego.
Dodaj 2 lub 3 krople odczynnika oksydazy Kovacs na papierze, weź udział w kolonii, którą chcesz uczyć się za pomocą platynowego uchwytu lub drewnianego patyka i rozszerz go w linii prostej na impregnowanym papierze odczynnikowym. Interpretuj w okresie od 5 do 10 sekund.
Z paskami przygotowanymi z cieśli, Suhrland i Morrison Reagent kolonia rozciąga się na suchym pasku. Ten sam pasek służy do wypróbowania kilku szczepów. Interpretuj na 10 sekund.
-Dyski (mbezpośredni etod)
Subtelnie zwilżone dyski komercyjne sterylną wodą destylowaną i pokonaj kolonię do zbadania. Zaleca się stosowanie płyt w 35 ° C, jeśli płytki są używane w temperaturze pokojowej lub w lodówce, reakcja jest nieco wolniejsza. Interpretuj zmianę koloru między 10 do 20 sekund.
Można zastosować kolonie zawarte we krwi lub czekoladzie.
-Dyski (metoda pośredni)
Zwilż album, jak opisano powyżej. Umieść go na pustym Petriego. Weź wystarczającą ilość kolonii, aby studiować za pomocą platynowego uchwytu lub drewnianego patyka i umieść na dysku. Interpretuj zmianę koloru między 10 do 20 sekund.
Używać
Rodzaj Neisseria i Acinetobacter czasami przypomina wiele morfologicznie, ponieważ chociaż gatunek Acinetobacter jest gramowym Bacillus, czasami może przyjmować formę Coid i rozpowszechniać w parach, symulując rodzaj Neisseria.
Może ci służyć: limnologiaW tym przypadku test oksydazy jest naprawdę przydatny. Neisseria płciowa jest pozytywna i ujemna Acinetobacter.
Jednak rodzaj Moraxella jest bardzo podobny do rodzaju Neisseria i oba dają pozytywną reakcję; Dlatego zawsze musimy przeprowadzać testy fermentacji węglowodanów w celu uzyskania ostatecznej identyfikacji.
Z drugiej strony test oksydazy jest przydatny do różnicowania bakterii należących do rodziny Enterobacteriaceae (cała ujemna oksydaza) innych fermerów, takich jak Pasturel, aeromony, plesiomonas (dodatnia oksydaza).
Rodzaj Vibrio i Helicobacter są również dodatnią oksydazą.
QA
Użyj znanych szczepów Escherichia coli jako kontrola negatywna i szczepy Pseudomonas aeruginosa jako kontrola pozytywna.
Ograniczenia
-Odczynniki muszą być używane świeżo przygotowane, ich okres użytkowania w temperaturze pokojowej jest krótki, ponieważ jest bardzo niestabilny. Lodówki może trwać od 5 do 2 tygodni.
-Odczynniki są bezbarwne, jeśli zmienią kolor, należy je odrzucić. Uszkodzone dyski są widoczne, ponieważ z czasem stają się ciemne.
-Pozytywna reakcja z odczynnikiem oksydazy KOVAC między 15-60 s jest uważana za opóźnioną reakcję, a po 60 sekundach należy uznać za ujemne.
-On Haemopylus influenzae Daje ujemną reakcję oksydazy, jeśli stosuje się jakikolwiek odczynnik z dimetylo-p-fenylenendianą, ale pozytywny, jeśli zastosowano odczynnik oksydazy KOVAC (tetrametylo-p-felendiamina) przydatne).
-Pożywki zawierające glukozę zakłócają test, fałszywie negatywny.
-Szczepy Bordetella pertussis Mogą podać fałszywie pozytywną reakcję, jeśli pochodzą z bardzo skoncentrowanych płytek agarowych krwi.
-Zastosowanie metalowych uchwytów (żelaza), co podaje fałszywie pozytywną reakcję.
Zalecenia
-Ponieważ odczynniki są bardzo niestabilne i mają tendencję.
-Innym sposobem na opóźnienie siebie odczynnika jest dodanie 0,1% kwasu askorbinowego w momencie przygotowywania odczynników.
-Ponieważ odczynniki są niestabilne, zaleca się wykonywanie cotygodniowej kontroli jakości.
-Nie należy stosować odczynników, które nie przechodzą testu kontroli jakości.
Bibliografia
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. Ed. Pan -american Editorial S.DO. Argentyna.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Pan -american Editorial S.DO. Argentyna.
- „Test oksydazy." Wikipedia, bezpłatna encyklopedia. Styczeń 2018, 10:32 UTC. Kwiecień 2019, 14:03
- Światowa Organizacja Zdrowia. Podręcznik laboratoryjny do identyfikacji i testu podatności na środki przeciwdrobnoustrojów bakteryjnych patogenów o zdrowiu publicznym w świecie rozwoju.2004. Dostępne w: Who.INT/BREAKSPOSTANCE/INFOSHARING
- Reaktywne paski do diagnozy aktywności oksydazy u bakterii. Kubańskie rev. 2000; 52 (2): 150-151.

