Fundacja testowa katalazy, technika i zastosowania

- 2495
- 441
- Marianna Czarnecki
katalaza Jest to metodologia stosowana w laboratoriach bakteriologii w celu podkreślenia obecności katalazy enzymu w tych bakteriach, które ją posiadają. Obok zabarwienia Grama znajdują się główne testy, które należy wykonać na świeżo izolowanych mikroorganizmach. Testy te kierują mikrobiologiem w zakresie kroków, które należy wykonać w celu ostatecznej identyfikacji danego mikroorganizmu.
Ogólnie rzecz biorąc, bakterie zawierające cytochrom mają enzym katlasowy, to znaczy aerobowe i opcjonalne bakterie beztlenowe powinny to posiadać. Istnieją jednak wyjątki, takie jak Streptococcus, które pomimo opcjonalnych mikroorganizmów beztlenowych nie posiadają enzymu katalazy.
 Wykonanie testu katalazy, wykazując pozytywną reakcję. Źródło: Brak, który można odczytać, nie dostarczył autora. Nase założył (na podstawie roszczeń dotyczących praw autorskich). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]]
Wykonanie testu katalazy, wykazując pozytywną reakcję. Źródło: Brak, który można odczytać, nie dostarczył autora. Nase założył (na podstawie roszczeń dotyczących praw autorskich). [CC BY-SA 3.0 (http: // creativeCommons.Org/licencje/by-sa/3.0/]] Właśnie dlatego test katalazy służy głównie do rozróżnienia gronkowca i mikrokokocaceae (oba dodatnia katalaza) rodziny Streptococaee (katalaza ujemna) (katalaza ujemna) (katalaza ujemna).
Podobnie rodzaj Bacillus (dodatnia katalaza) odróżnia między innymi od rodzaju Clostridium (katalaza ujemna), między innymi.
[TOC]
Podstawa
Katalaza jest enzymem sklasyfikowanym jako hydroperoksydaza, co oznacza, że wykorzystują nadtlenek wodoru jako substrat (H. H2ALBO2).
Jest również uważany za oksydoreduktazę, ponieważ w reakcji, w której istnieje element, który służy jako dawca elektronów (substancja redukująca), a drugi jako odbiornik elektronów (substancja utleniająca).
Katalaza jest białkiem, które zawiera grupę prostorową z czterema trójwartościowymi atomami żelaza (wiara+++) Dlatego jest homoproteiną. Jon żelazowy pozostaje utleniony podczas reakcji.
Można powiedzieć, że katalaza jest enzymem detoksykacyjnym, ponieważ jego funkcją jest eliminowanie substancji występujących podczas metabolizmu bakteryjnego, które są toksyczne dla bakterii. Wśród tych substancji jest nadtlenek wodoru.
Nadtlenek wodoru powstaje z rozkładu cukrów przez aerobię. Ten proces występuje w następujący sposób:
Jon ponadtlenkowy (lub2-) (Wolne rodniki) powstaje jako produkt końcowy asymilacji glukozy przez aerobic Road. Jest to toksyczne i jest eliminowane przez dysmutazę nadtlenkową enzymu, która przekształca ją w gazowy tlen i nadtlenek wodoru.
Może ci służyć: strefy życia Holdridge: co jest w Ameryce ŁacińskiejNadtlenek wodoru jest również toksyczny dla bakterii i musi zostać wyeliminowany. Enzym katalazy rozwija nadtlenek wodoru w wodzie i tlenu.
Katalaza może działać na inne substraty inne niż nadtlenek wodoru, takie jak alkohole, aldehydy, kwasy, aromatyczne aminy i fenole. Jednak nadtlenek wodoru może być również stosowany przez katalazę do utleniania innych toksycznych związków, takich jak alkohol metylowy i etylowy.
Podobnie katalaza jest obecna w komórkach fagocytarnych, chroniąc ją przed toksycznym działaniem nadtlenku wodoru.
Rutynowa technika testu katalazy
-Metoda w slajdzie
Materiały
3% nadtlenek wodoru (10 objętości).
Przenośna blaszka
Jednorazowy plastikowy uchwyt lub drewniany patyk.
Procedura
Weź wystarczającą ilość z kolonii, aby się uczyć bez dotykania agaru, z którego pochodzi. Kolonia musi być świeża, to znaczy z uprawy od 18 do 24 godzin.
Umieść kolonię na suchym uchwycie, a na niej dodaj kroplę 3% nadtlenku wodoru (możesz również użyć H2ALBO2 na 30%). Obserwuj natychmiast, jeśli pęcherzyki są odłączone, czy nie.
Interpretacja
Pozytywna reakcja: oderwanie gazu, które jest widoczne wraz z tworzeniem bąbelków (silny bąbelek).
Reakcja negatywna: nie ma tworzenia się bańki.
-Bezpośrednia metoda w czystej kulturze
Umieść 1 ml H2ALBO2 3% na czystej uprawach w płytkach lub klinach, które nie zawierają krwi (najlepiej pożywna uchwyt). Zauważ, czy następuje tworzenie bańki. Możesz także użyć h2ALBO2 30%.
Jest interpretowany tak jak metoda uchwytu obiektów.
-Metoda z rurką naczyń włosowatych lub grzybów i rurki Petrishko
Wypełnij rurkę kapilarną 67 mm na wysokości 20 mm z 3% nadtlenkiem wodoru na kapilarność.
Dotknij izolowanej kolonii, którą chcesz uczyć się z kapilarą pełną H2ALBO2 3%. Zauważ, czy kapilara jest wypełniona bąbelkami w około 10 sekund. Ta metoda pozwala na półtorowanie reakcji na krzyżach:
Bez krzyży nie ma pęcherzyków (reakcja negatywna).
Może ci służyć: flora i fauna wysp Falkland: wybitne gatunki+ --Rzadkie pęcherzyki (słaba lub opóźniona reakcja).
++ -Obfite bąbelki (umiarkowana reakcja).
+++ -Pęcherzyki docierają do przeciwnego końca (reakcja energetyczna).
-Metoda Taylor i Achanzar dla testów katalazy, które dają wątpliwe wątpliwości
W czystym i suchym slajdzie umieścił izolowaną kolonię, a następnie umieść kroplę H2ALBO2 0,5% i osłona za pomocą okładek. Zauważ, czy istnieje powstawanie uwięzionych bąbelków.
Interpretacja: Obecność pęcherzyków wskazuje na pozytywną reakcję. Bez pęcherzyków jest interpretowany jako reakcja negatywna.
Test katalazy dla gatunków Mycobacterium
Tę technikę należy wykonać poprzez kontrolowanie pH i temperatury. Musi zostać wykonany pod laminarnym dzwonkiem przepływowym, ponieważ manipulacja różnymi gatunkami Mycobacterium jest niebezpieczna.
-Materiały
30% lub 110 objętościowy nadtlenek wodoru (ponadpokserny).
Bufor fosforanowy pH 7
Między 80 do 10%
Kultura Mycobacterium w klinie od 3 do 4 tygodni
-Przygotowanie z odczynniki
Bufor fosforanowy pH 7
Ważyć:
1 361 g (KH2PO4) Anhydra.
1 420 g (Na2Hpo3) dysodyczny fosforan bezwodny.
Rozpuść obie sole w małej sterylnej wodzie destylowanej i kompletny z wodą do 1000 ml.
Między 80 do 10%
Wykonaj rozcieńczenie 1:10 do Tween 80, które jest skoncentrowane na rynku, aby to kontynuowane w następujący sposób:
Weź 1 ml Tween 80 i umieść go w małej wody destylowanej, rozpuść, a następnie uzupełnij objętość wodą do 10 ml.
Ostateczny odczynnik
Wymieszaj ilość buforu fosforanowego z ilością Tween 80 do 10% (w równych częściach). Zdefiniuj w laboratorium, ile chcesz przygotować.
-Procedura
Umieść 5 ml buforu fosforanowego w sterylnej rurce testowej z pokrywką nici (Baquelita).
Z rękawicą zaszczepienia weź wystarczającą kolonię wzrostu Mycobacterium wysiewanego w klinach i rozpuść w buforze fosforanowym.
Przykryć rurkę bez dokręcania nici. Umieść w łazience w 68 ° C przez 20 do 30 minut. Wyjmij i ostygnie w 22-25 ° C
Zmierz 0,5 ml końcowego odczynnika (mieszaninę) i dodaj ją do rurki za pomocą zimnego roztworu. Obserwuj lub nie tworzenie bąbelków.
Jest interpretowany, a także poprzednie techniki.
Używać
Po uzyskaniu wzrostu kolonii w wzbogaconych pożywkach, do uzyskanych kolonii należy przeprowadzić barwienie gram. To poprowadzi mikrobiologa o procedurach, które należy przestrzegać w celu ostatecznej identyfikacji.
Może ci służyć: prosty płaski nabłonek: cechy, funkcje i typy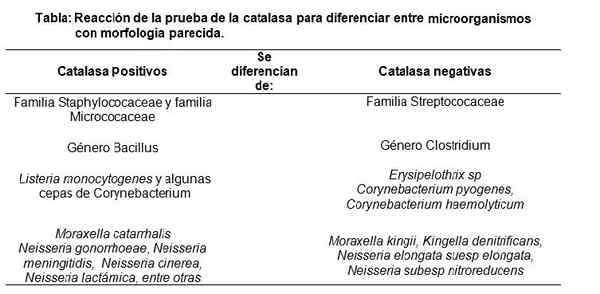 Źródło: przygotowane przez autora MSC. Marielsa Gil
Źródło: przygotowane przez autora MSC. Marielsa Gil QA
Aby ocenić właściwe funkcjonowanie odczynnika nadtlenku wodoru, zastosuj świeżo uprawiane kontrole, takie jak Staphylococcus aureus jako kontrola pozytywna i szczepy Streptococcus sp jako kontrola negatywna.
Inną alternatywą, która służy jako kontrola pozytywna, jest umieszczenie kropli nadtlenku wodoru na agaru krwi, erytrocyty mają katalazę, dlatego nastąpi bulgotanie, jeśli odczynnik jest w dobrym stanie.
Możesz użyć agaru czekoladowego jako kontroli negatywnej, tutaj erytrocyty są już wymienione, a test daje ujemne.
Ograniczenia
-Nie używaj starych upraw do testu, ponieważ może to powodować fałszywe negatywy.
-Unikaj przyjmowania kolonii z upraw w agarze krwi, jeśli uważasz, że nie dotknij agaru; Ta procedura może powodować fałszywe pozytywy, ponieważ erytrocyty zawierają katalazę.
-Jeśli weźmiesz kolonię z uchwytem platynowym, nie inwestuj kolejności procedury, ponieważ może to generować fałszywe pozytywy. Wynika to z faktu, że platyna jest w stanie reagować z nadtlerzem wodoru, pochodzącym z bańki.
-Nie używaj odczynnika nadtlenku wodoru, jeśli jest bardzo stary, ponieważ odczynnik jest bardzo niestabilny i ma tendencję do rozkładania się z czasem.
-Utrzymuj odczynnik nadtlenku wodoru przed światłem i chłodzeniem, aby zapobiec uszkodzeniu.
-Wykonaj kontrolę jakości do odczynnika nadtlenku wodoru za każdym razem, gdy jest używany.
-Weź pod uwagę, że jeśli H jest używane2ALBO2 przy 30% reakcje są silniejsze niż te wykonywane z H2ALBO2 3%.
Bibliografia
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnoza mikrobiologiczna. Ed. Pan -american Editorial S.DO. Argentyna.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnoza mikrobiologiczna Bailey & Scott. 12 ed. Pan -american Editorial S.DO. Argentyna.
- Mac Faddin J. (2003). Testy biochemiczne identyfikacji bakterii znaczenia klinicznego. Wydanie trzecie. Pan -american Editorial. Buenos Aires. Argentyna.
- BD Laboratories. Odczynnik katalazy. Dostępne na: http: // winklerltda.Cl
- Vadequímica Laboratories. Nadtlenek wodoru. Równoważność między objętościami a procentem. Dostępne na: Vadequimica.com

