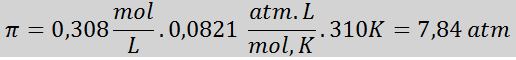Właściwości coligatywne rozwiązań
- 2395
- 370
- Maksymilian Kępa
Co to są właściwości kajgara?
Właściwości koligatywne, Nazywane również zbiorowymi właściwościami roztworów, są to grupa czterech właściwości, które zależą wyłącznie od ilości cząstek obecnych w roztworze, ale nie od charakteru tych cząstek.
Innymi słowy, właściwości te powstają z obecności cząstek innych niż rozpuszczalnik, to znaczy cząstki substancji rozpuszczonej, ale nie zależą od tego, kim jest substancja rozpuszczona. Każdy rodzaj cząstek może powodować powstanie właściwości kajglutu, bez względu na to, czy są to atomy, jony czy cząsteczki. Jedyne, co się liczy, to twoja koncentracja.
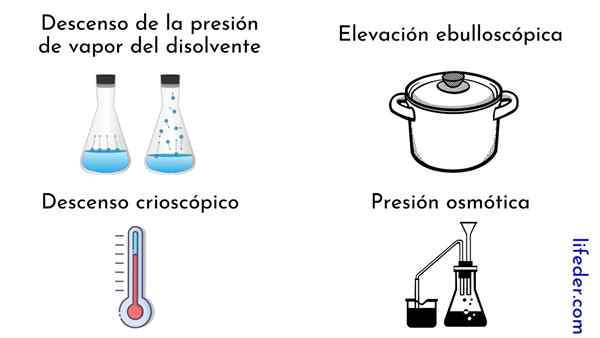
Właściwości koligatywne wynoszą cztery:
- Decyzja o ciśnieniu pary rozpuszczalnika
- Ebullloskopowe wysokość
- Kryoskopowe pochodzenie
- Ciśnienie osmotyczne
Wszystkie charakteryzują się proporcjonalnym do stężenia substancji rozpuszczonej w przypadku stosunkowo rozcieńczonych roztworów (stężenie <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Zobaczmy szczegółowo każdą z tych czterech właściwości:
1. Decyzja o ciśnieniu pary rozpuszczalnika
Gdy przygotowywany jest nielotny roztwór substancji rozpuszczonej, ciśnienie pary powstałego roztworu jest zawsze mniejsze niż ciśnienie pary czystego rozpuszczalnika. Innymi słowy, rozpuść nielotną substancję rozpuszczalnika w rozpuszczalniku, powoduje spadek ciśnienia pary wspomnianego rozpuszczalnika, w porównaniu z czystym rozpuszczalnikiem.
Wzór ciśnienia pary spadają
Podobnie jak wszystkie właściwości kajgara, spadek ciśnienia pary (DP) jest proporcjonalny do stężenia substancji rozpuszczonej. Łącząc prawo Rault z równania frakcji molowej, można wykazać, że DP jest podane przez:
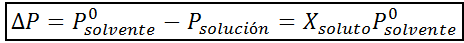
gdzie p °rozpuszczalnik reprezentuje ciśnienie pary czystego rozpuszczalnika w określonej temperaturze, prozwiązanie odpowiada ciśnieniu pary roztworu i xsubstancja rozpuszczona reprezentuje stężenie substancji rozpuszczonej wyrażonej jako frakcja molowa.
Dlaczego warto zmniejszać ciśnienie pary za pomocą substancji rozpuszczonej?
Siła, która napędza większość naturalnych procesów, takich jak odparowanie rozpuszczalnika, to wzrost entropii lub poziomu zaburzenia. Kiedy ciecz odparowuje, przechodzi od bardzo uporządkowanego (w cieczy) do bardzo niechlujnego (w gazie), ponieważ w fazie gazowej jest znacznie większa swoboda ruchu.
Może ci służyć: fioletowe szkłoJednak w roztworze obecność substancji rozpuszczonej dodaje zaburzenie do fazy ciekłej, a jednocześnie nie wpływa na fazę gazową (ponieważ substancja rozpuszczona nie odparowuje).
Z tego powodu różnica w poziomie zaburzenia między roztworem a fazą gazową jest mniejsza niż między czystym rozpuszczalnikiem a fazą gazową, więc rozpuszczalnik ma mniejszą tendencję do odparowywania w drugim przypadku.
Przykład
Problem: Wiedząc, że ciśnienie pary wodne w określonej temperaturze wynosi 30,55 mmHg, określ ciśnienie pary przygotowanego roztworu rozpuszczającego 7,20 gramów glukozy (masa molowa lub mm = 180 g/mol) w 360 g wody (mm = 18,0 g/mol) W tej samej temperaturze.
Rozwiązanie: W takim przypadku frakcja molowa substancji rozpuszczonej należy najpierw obliczyć. Mamy już wszystkie niezbędne dane do tego:
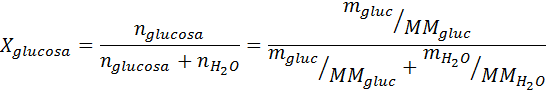
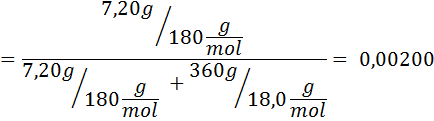
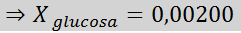
Wówczas stosuje się równanie spadku ciśnienia pary.
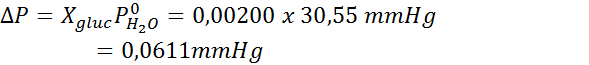
Teraz określamy nowe ciśnienie pary rozpuszczalnika:
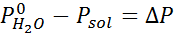
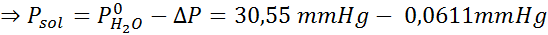
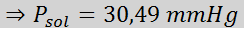
2. Ebullloskopowe wysokość lub temperatura wrzenia
Ebullloskopowe podniesienie odnosi się do wzrostu temperatury wrzenia roztworu w porównaniu z temperaturą wrzenia czystego rozpuszczalnika. Aby zrozumieć, dlaczego tak się dzieje, pamiętaj, że temperatura wrzenia jest zdefiniowana jako temperatura, w której ciśnienie pary cieczy odbywa się równe ciśnieniem atmosferycznym.
Ponieważ roztwory mają mniejsze ciśnienie pary niż czysty rozpuszczalnik (jak właśnie widzieliśmy w poprzednim rozdziale), konieczne jest podgrzanie go, aby móc osiągnąć ciśnienie atmosferyczne, a tym samym osiągnąć temperaturę wrzenia. Z tego powodu temperatura wrzenia roztworów (z subołotowymi substancjami substancji rozpuszczalników) jest zawsze większa niż w czystym rozpuszczalniku.
Ebullloskopowy wzór wysokościowy
Wzrost temperatury wrzenia (DTB) Jest proporcjonalny do stężenia substancji rozpuszczonej wyrażonej w molelualności, na co wskazuje następujące równanie:
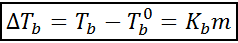
Gdzie tB Jest to temperatura wrzenia roztworu, tB° Jest to temperatura wrzenia czystego rozpuszczalnika, kB Jest to ebullloskopowa stała rozpuszczalnika i M Jest to molealowość substancji rozpuszczonej.
Przykład
Problem: Wiedząc, że stała wrzenia wody wynosi 0,52 ° C.kg/mol, określ temperaturę wrzenia roztworu glukozy przygotowanego w poprzednim przykładzie.
Rozwiązanie: Aby określić ebullloskopowe wysokość, potrzebujemy tylko moralności.
Może ci służyć: tlenek cyny (ii): struktura, właściwości, nomenklatura, zastosowania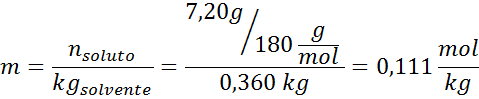
Teraz stosujemy formułę DTB:
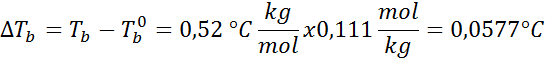
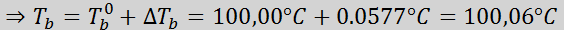
3. Kryoskopowe pochodzenie
Zmniejszenie krioskopowe to spadek punktu zamrażania roztworu w porównaniu z punktem zamrażania czystego rozpuszczalnika. Powód, dla którego tak się dzieje, jest podobny do wzrostu ebullloskopowego i ma swoje pochodzenie w spadku ciśnienia pary.
Ta nieruchomość jest szeroko stosowana w chłodne dni, gdzie pada zimą. W tych krajach bardzo często widzieć ciężarówki rozprzestrzeniające sole, takie jak NaCl lub CACL2 na drogach lub na publicznych ławkach, po czym topi się śnieg. Powodem, dla którego się topi, jest to, że sól zmniejsza punkt zamarzania wody.
Kryoskopowa formuła pochodzenia
Chryoskopowe równanie pochodzenia jest bardzo podobne do równania ebullloskopowego. Jest również proporcjonalny do stężenia moralnego i zależy w tym przypadku od krioskopowej stałej rozpuszczalnika.
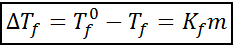
gdzie tF Jest to punkt zamrażania rozwiązania, tF° Jest to punkt zamrażania czystego rozpuszczalnika, kF Jest to chrioskopowa stała rozpuszczalnika i M Jest to molealowość substancji rozpuszczonej.
Przykład
Problem: Wiedząc, że krioskopowa stała wody wynosi 1,86 ° C.kg/mol, określ punkt zamrażania roztworu glukozy przygotowanego w poprzednim przykładzie.
Rozwiązanie: Moralność rozwiązania została już określona, więc możemy bezpośrednio określić DTF Korzystanie z poprzedniej formuły:
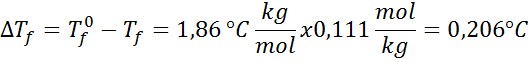
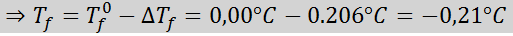
4. Ciśnienie osmotyczne
Osmoza jest procesem o wielkim znaczeniu na poziomie chemicznym i biologicznym. Składa się z przepływu cząsteczek rozpuszczalnika (na przykład wody) z rozcieńczonego roztworu do innego bardziej skoncentrowanego roztworu, gdy są one oddzielone za pomocą półprzepuszczalnej membrany (która pozwala tylko przepływać rozpuszczalnik, ale nie substancję rozpuszczoną).
Ta tendencja do „wchłaniania” rozpuszczalnika przez półprzepuszczalną błonę jest właściwością, która zależy wyłącznie od całkowitego stężenia cząstek substancji rozpuszczonej obecnych w roztworze, niezależnie od tego, jakie to jest substancje rozpuszczone. Z tego powodu ten trend jest właściwością coligatową i jest mierzona ciśnieniem osmotycznym.
Ciśnienie osmotyczne (π) to ciśnienie, które należy zastosować do roztworu, aby zatrzymać osmozę. Im większe ciśnienie osmotyczne, tym większa tendencja roztwór do wchłaniania rozpuszczalnika (a dokładniej, tym bardziej trend rozpuszczalnik do rozprzestrzeniania się w kierunku tego roztworu) ma roztwór).
Może ci służyć: magnez: historia, struktura, właściwości, reakcje, zastosowaniaDlaczego zdarza się osmoza?
Wyjaśnienie procesu osmozy jest bardzo proste. Wszystkie substancje mają tendencję do rozprzestrzeniania się od miejsca, w którym są bardziej skoncentrowane tam, gdzie są bardziej rozcieńczone. Mówi się, że podąża za gradientem koncentracji.
Gdy roztwór jest bardziej skoncentrowany w substancji rozpuszczonej, jednocześnie jest bardziej rozcieńczony w rozpuszczalniku i odwrotnie. Z tego powodu rozpuszczalnik ma naturalną tendencję do wychodzenia z najbardziej rozcieńczonego roztworu (gdzie rozpuszczalnik jest bardziej skoncentrowany) w kierunku najbardziej skoncentrowanego roztworu (gdzie jest bardziej rozcieńczony).
Formuła ciśnienia osmotycznego
Ciśnienie osmotyczne można obliczyć za pomocą wzoru bardzo podobnego do równania gazów idealnych:
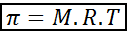
W tym równaniu π jest ciśnieniem osmotycznym, M jest stężeniem molowym substancji rozpuszczonej, R jest uniwersalną stałą gazów idealnych (0,0821 atm atm.L/mol.K) i t to temperatura bezwzględna w k.
Ciśnienie osmotyczne i toniczność
Ciśnienie osmotyczne jest bardzo ważne dla funkcjonowania ludzkiego ciała. W rzeczywistości roztwory soli fizjologicznej, które są wstrzykiwane dożylnie, są klasyfikowane według tego, czy ich ciśnienie osmotyczne jest większe, równe czy mniej niż w osoczu krwi z tak zwanym tonicznością.
- Mniej skoncentrowane roztworze, że osocze ma niższe ciśnienie osmotyczne i jest powiedziane Roztwór hipotoniczny.
- Jeśli masz takie samo całkowite stężenie substancji rozpuszczonych roztwór izotoniczny.
- Jeśli masz większe ciśnienie osmotyczne (lub stężenie), mówi się Rozwiązanie hipertoniczne.
Przykład
Problem: Oblicz ciśnienie osmotyczne przy 310 K roztworu soli fizjologicznej 0,9% (m/v), który jest izotoniczny z osoczem krwi.
Rozwiązanie: Mamy już temperaturę, więc jedyną rzeczą, która brakuje, jest określenie stężenia molowego cząstek soli (NaCl) w roztworze. Dla tego.
Każde 100 ml roztworu zawiera 0,9 g NaCl, więc:
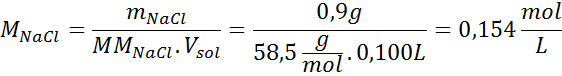
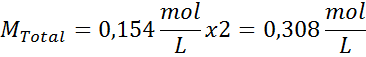
Jest to całkowite stężenie cząstek substancji rozpuszczonej w roztworze, więc teraz możemy obliczyć ciśnienie osmotyczne: