Siły międzycząsteczkowe
- 1987
- 354
- Herbert Wróblewski
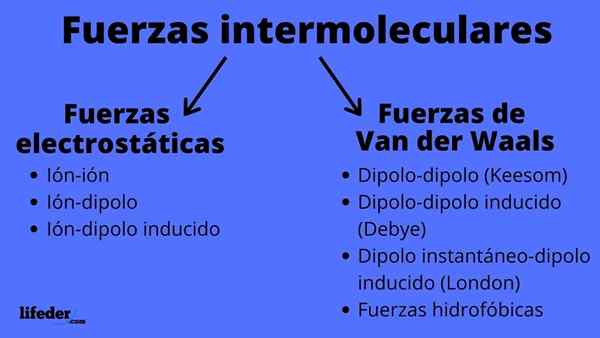 Schemat typów sił międzycząsteczkowych
Schemat typów sił międzycząsteczkowych Jakie są siły międzycząsteczkowe?
Siły międzycząsteczkowe Są to zestaw interakcji, które zachodzą między cząsteczkami, czy to z tego samego związku chemicznego, czy nie, i które utrzymują je razem. Dzięki tym siłom cząsteczki udaje się grupować i zdefiniować stałe, ciekłe lub gazowe; to znaczy są odpowiedzialne za fizyczne właściwości substancji.
Siły międzycząsteczkowe mogą mieć dwa typy: elektrostatyczne lub van der waals. Te elektrostatyczne to wszystkie, w których mamy jony, które są obciążonymi elektrycznie atomami lub cząsteczkami (+ lub -). Tymczasem te z Van der Waalsa obejmują neutralne atomy lub cząsteczki, które przez fluktuacje ich rozkładu elektronicznego są spolaryzowane i przyciągane lub odpychane ze sobą.
Siły międzycząsteczkowe można porównać do istniejącego związku między różnymi dziełami świeckich. W zależności od ich form i wytycznych ich związki stają się słabsze lub słabsze, podobnie jak zmieniają projekt i końcowe wymiary budowy.
Im silniejsze są te siły, tym trudniejsze będzie oddzielenie kawałków świeckich lub, w przypadku chemii, cząsteczki. Oznacza to również, że nastąpi większe zagęszczenie, a zatem cząsteczki zdefiniują bardziej lepkie ciecze, cięższe lub gęstsze gazy.
Inne właściwości fizyczne, takie jak punkty fuzji i wrzenia, zmienność, tekstura itp., Są to również makroskopowe odruch sił międzycząsteczkowych regulujących między cząsteczkami lub jonami związku lub mieszanin. Na przykład: siły międzycząsteczkowe gazów są bardzo słabe w porównaniu z siłami kamienia.
Zrozumienie sił międzycząsteczkowych jest niezbędne do opisania wielu pojęć chemicznych, fizycznych i biologicznych.
Siły elektrostatyczne
Jon-jon
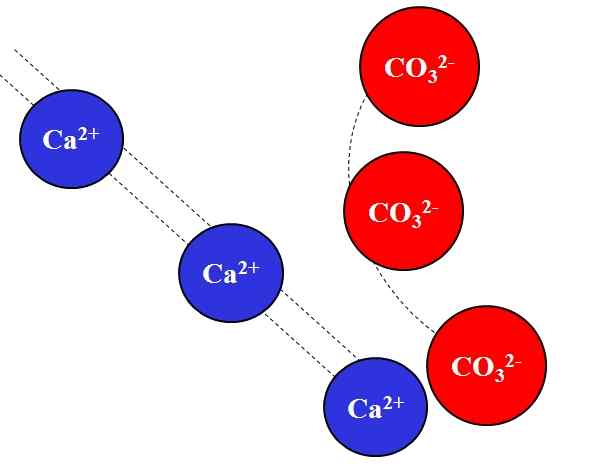 Przyciąganie elektrostatyczne między jonami Ca2+ i CO32-. Źródło: Gabriel Bolívar.
Przyciąganie elektrostatyczne między jonami Ca2+ i CO32-. Źródło: Gabriel Bolívar. Przeciwne zarzuty jony przyciągają wielką siłę, co jest spowodowane prawem Coulomba, i szybko zmniejsza, im bardziej jony się odsuwają.
Na przykład Ca Ion2+ Jest to ładunek dodatnia, kation, a CO32- Jest to jon obciążenia ujemnego, anion. Będąc przeciwnymi obciążeniami, CA2+ i co32- Przyciągają się nawzajem, co dowodzi, że im bliżej, tym bardziej razem pozostaną.
Przeciwnie, jony o tym samym obciążeniu, zarówno dodatnie, jak i negatywne, odpychają z tą samą siłą, ale w przeciwnym znaczeniu. Zatem CA2+ Odstraszanie jonów takich jak Na+, Mg2+, K+, itp., chyba że istnieją inne aniony, które zmniejszają odpychanie.
Może ci służyć: Dibenzalacetona: właściwości, mechanizm reakcji, zastosowania, ryzykoSpośród wszystkich sił międzycząsteczkowych, te z typu jonowego są najprostsze; Ale jednocześnie najsilniejszy ze wszystkich. Potrzebne jest dużo energii lub ciepła do oddzielenia jonów.
Ion-Dipolo
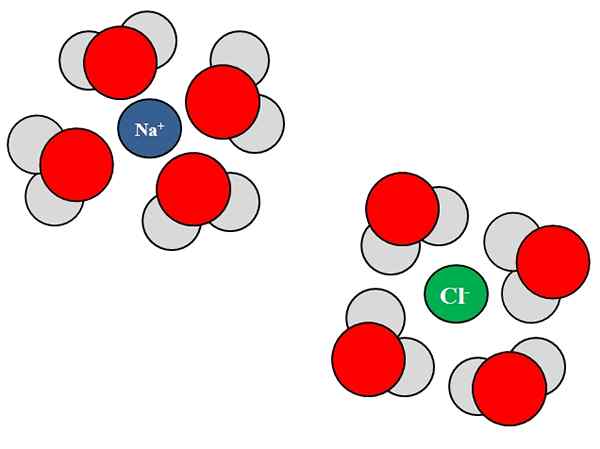 Interakcje jon-dipolo między cząsteczkami wody i jonami NaCl. Źródło: Gabriel Bolívar.
Interakcje jon-dipolo między cząsteczkami wody i jonami NaCl. Źródło: Gabriel Bolívar. Jone mogą również oddziaływać z neutralnymi atomami lub cząsteczkami, takimi jak woda. Jest to szczególnie prawdziwe, jeśli chodzi o cząsteczki rozpuszczalnika, które Solvata, to znaczy, otacza jony w ich cieczy.
Na przykład chlorek sodu, NaCl, składa się z jonów Na+ i Cl-. Kiedy ich kryształy są wrzucane do wody, cząsteczki wody, h2O lub hoh, nawilżaj lub otaczają jony NaCl; Ale sposób, w jaki się to robią, jest różny w zależności od omawianego jonu.
Zatem widzimy na lepszym obrazie, że jon na+ jest uwodnione przez atomy tlenu H H2ALBO. Tymczasem jon cl- jest nawodniony przez atomy wodoru.
Ponieważ? Ponieważ woda jest substancją polarną, co oznacza, że ma dipol: słup z dodatnim obciążeniem częściowym, a drugi z ujemnym obciążeniem częściowym.
Atom tlenu, ponieważ jest bardziej elektroungcyjny, przyciąga do siebie elektron, w ten sposób częściej lokalizując elektrony wokół tego atomu; coś, co nie zdarza się tak samo z atomami wodoru, mniej elektroonywentami. Tlen, ponieważ jest bardziej ujemny, jest zorientowany w kierunku Na+; Podczas gdy hydrogeny, ponieważ są bardziej pozytywne, są zorientowane w kierunku CL-, Ponieważ przyciągane są przeciwne opłaty.
Indukowane jon-dipolo
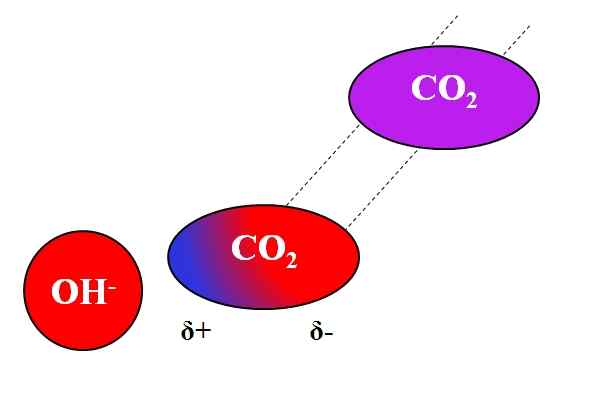 Działanie indukcyjne OH- na cząsteczce co₂. Źródło: Gabriel Bolívar.
Działanie indukcyjne OH- na cząsteczce co₂. Źródło: Gabriel Bolívar. Nie tylko cząsteczki polarne lub dipole mogą oddziaływać z jonami. W przypadku neutralnych atomów lub cząsteczek, nawet jeśli nie mają dipoli, rozkład ich elektronów jest podatny na indukcyjne działanie pobliskich jonów; Oznacza to, że jony powodują chwilową i krótką polaryzację, wystarczającą do znaczącej interakcji.
Może ci służyć: octan ołowiu: struktura, właściwości, uzyskiwanie, użyciaZałóżmy, że na przykład interakcja między jonem OH- i co2. Co2 Jest to neutralny związek, którego cząsteczce (w fioletowym) brakuje dipola. Jednak w miarę zbliżania się-, Ujemne obciążenie tego odpychania do elektronów atomów tlenu Co2.
Im bliżej OH- i co2, silniejsze będzie odpychanie. W konsekwencji zaczyna się ustanawiać dipol wywołany przez OH- O CO2. Piernikowy biegun pojawia się δ+, ponieważ elektrony odpychane „emigrują” na drugi koniec cząsteczki.
Tak, och- i co2 Pozostają wystarczająco razem, aby zareagować ze sobą. To jest powód, dla którego Co2 Jest szczególnie rozpuszczalny w roztworach alkalicznych.
Siły van der waals
Siły van der Waalsa w zasadzie odnoszą się tylko do tych, które istnieją między neutralnymi atomami lub cząsteczkami, bez obciążeń jonowych.
Dipolo-Dipolo (Keesom)
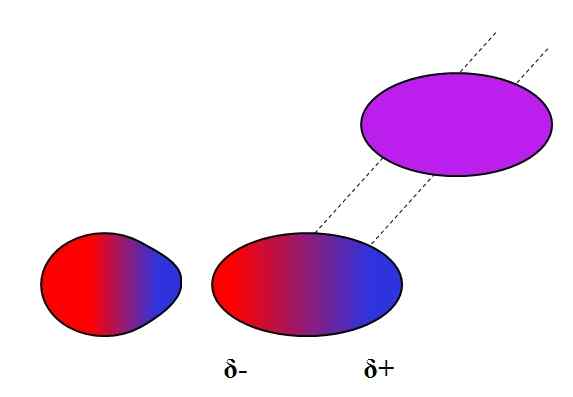
 Siły Dipolo-Dipolo. Źródło: Gabriel Bolívar.
Siły Dipolo-Dipolo. Źródło: Gabriel Bolívar. Przyciągane są przeciwne ładunki, równe obciążenia odpychają. To samo dotyczy dipoli: przyciągane są biegunki przeciwne (δ+ i δ-), podczas gdy równe bieguny odpychają. Pozytywne bieguny lub δ+ są reprezentowane powyżej niebieskim kolorem, jednak bieguny ujemne lub δ- są reprezentowane czerwonym kolorem.
Zwróć uwagę, w jaki sposób górne cząsteczki są zorientowane i uporządkowane w taki sposób, że są przeciwne bieguny, odchodząc w procesie do tych samych biegunów. To uporządkowanie jest tak zwane interakcje lub siły Dipolo-Dipolo (siły Keesom) i są najważniejszymi siłami międzycząsteczkowymi między cząsteczkami polarnymi.
Na przykład cząsteczki H2Lub, HCL, HF, CO, między innymi, są one uporządkowane w podobnych trybach. Im bardziej są polarne, tym silniejsze będą siły dipol-dipolo; I dlatego trudniej będzie oddzielić ich cząsteczki.
HF jest bardziej polarny niż HCL, więc temperatura wrzenia HF jest lepsza (19.5 ° C) do HCl (-85.05 ºC). Niewiarygodny jest wpływ sił międzycząsteczkowych na właściwości fizyczne. Najmniejsza zmienność, a substancja będzie zachowywać się zupełnie inaczej niż oczekiwano.
Może ci służyć: stan gazowy: cechy, prawo ogólne, przykładyIndukowane Dipolo-Dipolo (Debye)
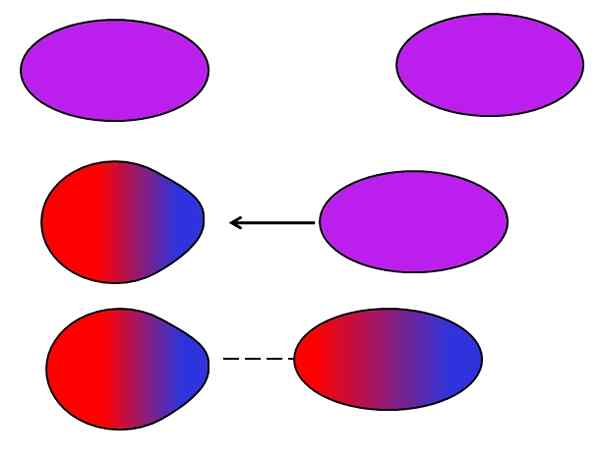
 Indukowane Dipolo-Dipolo. Źródło: Gabriel Bolívar.
Indukowane Dipolo-Dipolo. Źródło: Gabriel Bolívar. Dipolos, podobnie jak jony, mogą również zmieniać lub wpływać na elektroniczny rozkład neutralnych atomów lub cząsteczek. W ten sposób widzimy na obrazie, że dipol nagle polaryzuje neutralną cząsteczkę. Mówi się zatem, że jest to indukowana siła-dipol-dipolowa, ponieważ drugi dipol jest chwilowy, a nie trwały.
Na przykład woda jest w stanie rozwiązać niewielką ilość lub2, Ale wystarczy, aby fauna morska mogła oddychać. Jeśli h2Lub nie mógł wywołać dipola w O2, Cały tlen morza uciekłby z powierzchni, ponieważ nie byłoby interakcji między obiema cząsteczkami.
Instant Indukowany Dipolo Dipolo (Londyn)
 Londyńskie siły. Źródło: Gabriel Bolívar.
Londyńskie siły. Źródło: Gabriel Bolívar. Atomy neutralne lub cząsteczki nie potrzebują sąsiednich jonów ani dipoli, aby cierpieć za siebie wahania rozmieszczenia ich obciążeń wewnętrznych. Elektrony nie są nieruchome, ale poruszają się po cząsteczce. W pewnym momencie nastąpi natychmiastowy dipol, który, jeśli jest bardzo blisko neutralnej cząsteczki lub atomu, indukuje w nich dipol (patrz wyżej).
Im większe i asymetryczne te cząsteczki, tym większe prawdopodobieństwo wystąpienia natychmiastowych dipoli. Dlatego związki najwyższych mas atomowych mają indukowane natychmiastowe siły diody. Ten typ sił Van der Waals jest lepiej znany jako siły londyńskie.
Na przykład szlachetne gazy (on, NE, AR itp.) Pozostają zjednoczeni dzięki siłom londyńskim, podobnie jak gazy lotnicze (lub2, N2, WSPÓŁ2, itp.). Również siła ta jest najbardziej dominująca wśród węglowodorów, takich jak metan, cho4, I propan, cho3Ch2Ch3.
Siły hydrofobowe
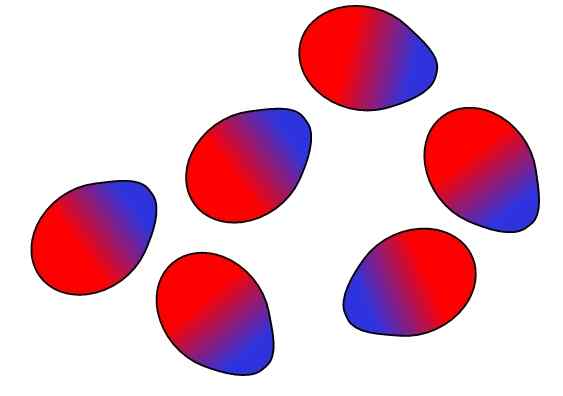
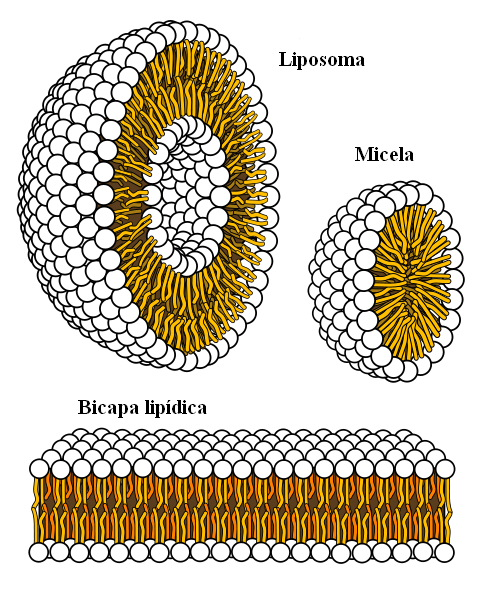 Struktury supramolekularne pochodzą z sił hydrofobowych
Struktury supramolekularne pochodzą z sił hydrofobowych Wreszcie mamy siły hydrofobowe, które są specjalnym wynikiem sił i odpychania między substancjami o różnych polaryzacji. Tłuszcze są niewiele powiązane z wodą, więc jest w tym nierozpuszczalny.
Cząsteczki tłuszczu starają się grupować w taki sposób, że ich interakcje z wodą są w jak największym stopniu, a to udaje się tworzyć struktury 3D, takie jak te pokazane powyżej.
Zatem cząsteczki tłuszczu, takie jak fosfolipidy, łączą się, tworząc dwuwarstwy lipidowe, micele i liposomy.
Jeśli zaobserwowano, cząsteczki te mają białą głowę reprezentującą część polarną, związaną z wodą; a także nie apolowy ogon, który odpycha cząsteczki wody. Linie starają się umieścić w tych strukturach supramolekularnych, aby nie wchodzić w interakcje z wodą.

