Struktura nadtlenku wodoru (H2O2), właściwości, stosowanie, uzyskiwanie
- 2868
- 468
- Herbert Wróblewski
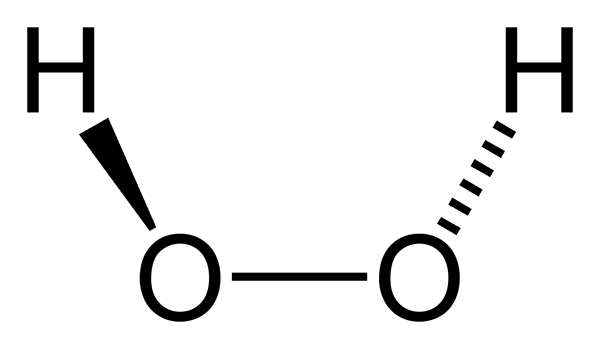
On nadtlenek wodoru Jest to związek nieorganiczny, którego wzorem chemicznym jest h2ALBO2. Wszyscy są najprostszym nadtlerzem tej rodziny związków chemicznych. Jego formuła strukturalna to H-O-O-H, ten wewnętrzny utleniony most jest charakterystyczny dla wszystkich nadtlenków.
W 1818 r. H2ALBO2 Został zidentyfikowany przez Louiesa Jacquesa Thénarda, który przygotował związek chemiczny, do którego wezwał wówczas Huzigenada. Jest to niestabilny związek, rozkłada się przez ekspozycję na światło, ciepło i niektóre metale.
 Chemiczny wzór nadtlenku wodoru
Chemiczny wzór nadtlenku wodoru Jest to bardzo przydatny związek stosowany w dezynfekcji drobnych ran, bielenie włosów, obróbki wody itp. Chociaż może mieć szkodliwe działania dla istoty ludzkiej, znajduje się to we wszystkich komórkach eukariotycznych żywych istot, gdzie pełni kilka korzystnych funkcji.
Nadtlenek wodoru wytwarza utlenianie toksycznych substancji, takich jak fenole, etanol, formaldehyd itp., produkty eliminowane przez wątrobę i nerki. Ponadto przyczynia się do zniszczenia bakterii fagocydowanych przez neutrofilowe i makrofagowe leukocyty.
[TOC]
Struktura
Cząsteczka
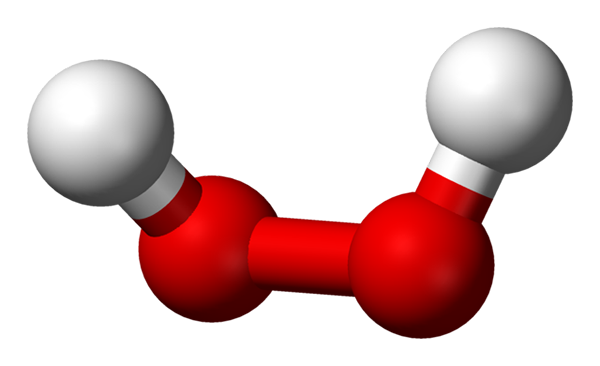 Cząsteczka nadtlenku wodoru reprezentowana za pomocą modelu sfer i słupków. Źródło: Benjah-BMM27 przez Wikipedia.
Cząsteczka nadtlenku wodoru reprezentowana za pomocą modelu sfer i słupków. Źródło: Benjah-BMM27 przez Wikipedia. Na górnym obrazie można zobaczyć strukturę cząsteczki H2ALBO2 (H-O-O-H), z czerwonymi kulami odpowiadającymi atomom tlenu i białymi atomami wodoru. Należy zauważyć, że cząsteczka nie jest płaska i że ani atomy H nie są zaćmienia w przestrzeni (jeden przed drugim).
Co ciekawe, do h2ALBO2 Trudno jest obrócić prosty centralny link O-O, więc pozycji tych H nie można wymienić; Jeden nie spadnie, gdy drugi wzrośnie.
Ponieważ? Ponieważ w dwóch atomach tlenu znajdują się dwie pary wolne od elektronów, co daje w sumie osiem bardzo bliskich elektronów.
Rotacje
Mimo to łącze O-O prawdopodobnie będzie się obrócić z powodu interakcji z otoczeniem.
Na przykład, gdy razem z dwoma kciukami, z rozszerzonymi palcami i innymi zamkniętymi, takimi jak rysowanie sądu, a następnie obracanie kciuków w taki sposób, że jeden z palców będzie się skierował do przodu, a drugie do tyłu, będzie przybliżona reprezentacja H2ALBO2.
Jeśli ciało odtwarza którekolwiek z wskaźników, kciuki obrócą się w odpowiedzi na tę interakcję; Jednak natychmiast powrócą do pierwotnej pozycji z powodu elektronicznych odpychania wymienionych powyżej. Te obroty stanowi dynamiczne aspekty tej cząsteczki.
Interakcje międzycząsteczkowe
W stanie płynnym h2ALBO2 udaje się ustanowić mosty wodorowe (hooh-o2H2), w przeciwnym razie jego wysoka temperatura wrzenia (150 ° C) nie zostanie wyjaśniona w porównaniu z wodą.
Może ci służyć: siarczan wapnia (przypadek 4): struktura chemiczna, właściwości, zastosowaniaPo przejściu do fazy gazowej cząsteczki M2ALBO2 Przypuszczalnie nie może już tworzyć takich mostów, nie tylko do największej odległości międzycząsteczkowej, ale także atomy wodoru jako pierwsze, które zostaną dotknięte w przypadku zderzeń (można to wizualizować, uciekając się z powrotem do modelu palców).
Tymczasem w fazie stałej kąt płaszczyzn, który ustanawia H, wynosi 90º (umieszczaj palce prostopadłe) palce). Teraz mosty wodorowe stają się jeszcze ważniejsze, a cząsteczki H2ALBO2 Są one uporządkowane w krysztale konstrukcji tetragonalnej.
Nieruchomości
Sbotella z nadtlenkiem wodoru. W aptekach osiąga się przy stężeniu 3% m/v. Źródło: Pixnio.
Nazwy
-Nadtlenek wodoru
-Dioksidano
-Oksydanol
-Kwas perhydoksyczny
-O-hydroksyol
-Nadtlenek wodoru
Masa cząsteczkowa
34,0147 g/mol
Wygląd fizyczny
Jasnoniebieski (skoncentrowany) lub bezbarwny. Jest nieco bardziej lepki i gęsty niż woda. Jest destylowany dla bezpieczeństwa w niskich temperaturach i zmniejszonym ciśnieniu, ponieważ rozkłada się przez wybuchowe ogrzewanie.
Zapach
Ostry lub zapach podobny do ozonu.
Smak
Gorzki
Gęstość
Solid 1,71 g/cm3
Gęstość ich wodnych roztworów zależy od ich koncentracji; Na przykład 27 % ma gęstość 1,10 g/cm3, podczas gdy 50 %, 1,13 g/cm3
Temperatura topnienia
- 0,43 ° C
Punkt wrzenia
150,2 ºC. Wartość tę uzyskano przez ekstrapolację, ponieważ nadtlenek wodoru rozkłada się w wysokich temperaturach.
Rozpuszczalność wody
Mieszalne ≥ 100 mg/ml w 25 ° C
Rozpuszczalność
Jest rozpuszczalny w eterze i alkohole, ale nierozpuszczalny w eterze olejowym. Rozkłada się w wodzie i tlenu w wielu rozpuszczalnikach organicznych.
Współczynnik podziału oktanol/wodę
Log P = - 0,43
Ciśnienie pary
5 mmHg w 30 ° C.
Stała dysocjacji
PKA = 11,72
Ph
Roztwory nadtlenku wodoru są lekko kwaśne. Na przykład od jednego do 35% ma pH 4,6; Ale koncentrując się na 90%, pH staje się mniej kwaśne: 5.1.
Wskaźnik refrakcji (nD)
1 4061
Breja
1245 cpoise w 20 ° C.
Pojemność cieplna
1 267 J/g · k (gaz)
2619 J/g · k (ciecz)
Ciepło parowe
1 519 J/g · k
Stabilność
Stabilne w zalecanych warunkach. Dodanie soli acetanylidu i cyny ustabilizują się bardziej.
Korozja
Żrący
Rozkład
Rozkłada się przez narażenie na światło lub w obecności substancji utleniania i redukujących. Jest również rozkładany przez ocieplenie. Po skonfisku woda i tlen są uwalniane i faworyzowane przez wzrost pH i temperatury, a także obecność enzymu katlasowego.
Może ci służyć: nadtlenek sodu (Na2O2): struktura, właściwości, zastosowaniaNapięcie powierzchniowe
80,4 DINS/CM A 20 ° C
Reaktywność
H2ALBO2 Działa jako środek utleniający w kwasowych roztworach żelaza żelaza (wiara2+) Żelazo żelaza (f3+); również utleniaj jon siarczkowy (więc32-) do jonu siarczanu (więc42-).
Może również działać jako środek redukujący w obecności podstawowych roztworów, zmniejszając się do podchlorynu sodu (NaOCL) i permangananu potasu (KMNO4) Z uwalnianiem tlenu.
Aplikacje
Bielenie
Nadtlenek wodoru jest stosowany w branży papierowej w wybielaniu miazgi i papieru, co zużywa większość jego rocznej produkcji.
Środek dezynfekujący
Nadtlenek wodoru jest delikatnym antyseptykiem, aby uniknąć małej infekcji rany, zadrapania i oparzeń. Jest również stosowany jako płukanie jamy ustnej i do złagodzenia łagodnego podrażnienia jamy ustnej z powodu obecności ustników lub zapalenia dziąseł.
Służy również do dezynfekcji powierzchni, wnętrza lodówek, wody i zwalczania nadmiernego wzrostu bakterii w systemach wodnych i wież chłodniczych. Nadtlenek wodoru uwalnia rodniki pozbawione tlenu, które rozkładają zanieczyszczenia.
Detergent
Nadtlenek wodoru stosuje się do produkcji detergentów wybielających ubrania, w tym węglanu sodu. Związek ten jest kompleksem węglanu sodu i nadtlenku wodoru, który rozpuszcza się w wodzie oddzielającej się w jego składnikach.
Zastosowanie kosmetyczne
Rozcieńczony nadtlenek wodoru jest stosowany w bieleniu włosów, przed barwieniem. Służy również do wybielania zębów, w ramach domowego kremu dentystycznego.
Gaz pędny
Nadtlenek wodoru jest stosowany jako monoporporant lub komponent utleniający dwuproponową rakietę. Rozkłada uwalnianie tlenu i wody, co pozwoliło na jego użycie jako palika.
Komórka reakcyjna jest pompowana obecnością katalizatora, który przyspiesza wspomniany rozkład. W tym czasie pary wodne jest wytwarzane w wysokiej temperaturze.
Gdy para jest wydalana przez szczelinę, powoduje impuls. Smokaryna V-80 zbudowana w 1940 r., Zastosowana w turbinach tlenowych wytwarzanych z nadtlenku wodoru; zwany systemem turbin Walter.
Uzyskanie
Początkowo nadtlenek wodoru uzyskano przemysłowo przez hydrolizę persulfate amonu, [(NH4)2S2ALBO8] lub elektroliza nieustępołów amonu, NH4Hso4.
Nadtlenek wodoru jest uzyskiwany przemysłowo dzięki zastosowaniu antraquinon. Proces przeprowadzany jest w czterech etapach: uwodornienie, filtracja, utlenianie, ekstrakcja i oczyszczanie.
Może ci służyć: fluor magnezowy: struktura, właściwości, synteza, zastosowaniaUwodornienie
Alquilantroquinona jest uwodorniona przez przepuszczanie gazu wodorowego przez wodorator obciążony tlenkiem glinu i niewielką ilością katalizatora (Paladium). Temperatura utrzymuje się w temperaturze 45 ° C przy stałym mieszaniu.
Alkyndroquinon jest przekształcony w Alquiloantrahydroquinona i tetrahydroalquilantrahydroquinone, wybierając ten ostatni dla największej wygody dla następujących procedur następujących procedur.
Filtrowanie
Rozwiązanie zawarte.
Utlenianie
Przefiltowany roztwór utlenia się przez przepuszczanie przez niego powietrza, tworząc nadtlenek wodoru o niskiej czystości.
Ekstrakcja i oczyszczanie
Roztwór z nadtlenkiem wodoru przekracza kolumnę ekstrakcji ciekłobójczej. Woda przepływa przez kolumnę, podczas gdy roztwór z nadtlenkiem wodoru jest przez nią pompowany.
Woda dociera do dna ekstraktora o stężeniu nadtlenku wodoru między 25 a 35 % P/P. Następnie jest oczyszczany przez destylację próżniową, do 30 % stężenia nadtlenku wodoru. Ostatecznie ustabilizowane i przechowywane.
Ryzyko
 Spalanie nadtlenku wodoru. Źródło: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Spalanie nadtlenku wodoru. Źródło: Bobjgalindo [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Nadtlenek wodoru jest środkiem korozyjnym, więc kontakt skóry powoduje ciężkie podrażnienie, oprócz tymczasowego wybielającego (obraz doskonały). Może również wywoływać uszkodzenie oczu, swędzenie, salpt, zaczerwienienie i tworzenie ampułki.
Jego wdychanie powoduje podrażnienie w nosie, gardle i płucach. Tymczasem wielokrotne narażenie może powodować zapalenie oskrzeli, kaszel, flegmę i skracanie oddechu. I jakby to było mało, generuje również ból głowy, vahid, nudności i wymioty.
Poważna ekspozycja na nadtlenek wodoru może powodować akumulację cieczy w płucach, znana jako obrzęk płuc: poważny stan, który wymaga szybkiej pomocy medycznej.
Administracja bezpieczeństwa i zdrowia w pracy (OSHA) ustaliła maksymalną dopuszczalną nadtlenek wodoru 1 ppm w środowisku pracy w ciągu 8 -godzinnego dnia. Jednak ponieważ jest to związek mutagenowy, ekspozycja na minimum musi zostać zmniejszona.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2019). Nadtlenek wodoru. Źródło: w:.Wikipedia.org
- William r. Busing i Henri a. Nałożyć. (2004). Struktura kryształu i molekularnej nadtlenku wodoru: badanie dyfrakcyjne neutronowe. doi.Org/10.1063/1.1696379
- National Center for Biotechnology Information. (2019). Nadtlenek wodoru. Baza danych Pubchem. CID = 784. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Redaktorzy Enyclopaedia Britannica. (27 listopada 2018 r.). Nadtlenek wodoru. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Departament Zdrowia w New Jersey. (2016). Nadtlenek wodoru. [PDF]. Odzyskane z: NJ.Gov
- Mathews, c. K., Van Holde, K. I., Ahern, k. G. (2002). Biochemia. Trzecia edycja. Pearson Addison Wesley Editorial
- MD Web. (2019). Nadtlenek wodoru. Źródło: webmd.com
- « Historia medycyny azteckiej, Bóg, rośliny, choroby
- Struktura tlenku cynku (ZnO), właściwości, zastosowania, ryzyko »

