Charakterystyka oksymoglobiny, struktura i krzywa połączenia
- 2127
- 495
- Estera Wojtkowiak
ALBOXihemoglobin Jest to nazwa, którą hemoglobina otrzymuje, gdy dołącza do tlenu. Hemoglobina jest białkiem, które znajduje się w czerwonych krwinkach i której główną funkcją jest transport tlenu z płuc do tkanek.
Pierwsze żywe istoty były jednokomórkowe i żyły w płynnej atmosferze, z której zostały odżywione i do których wyeliminowały swoje odpady, a także niektóre z obecnie istniejących organizmów. W tych warunkach procesy te są osiągane przez proste mechanizmy rozpowszechniania, ponieważ ściana komórkowa jest w intymnym kontakcie z medium.
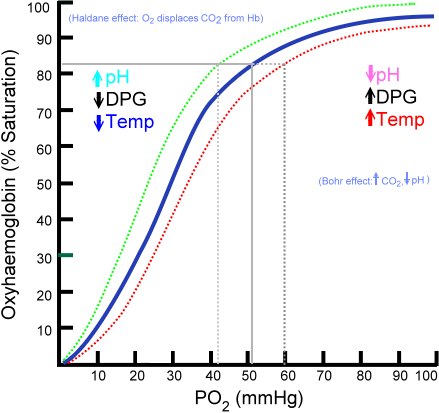
 Krzywa dysocjacji oksyhemoglobiny (źródło: ratznium w angielskiej wersji Wikipedialat zostały przesłane przez Aaronsharpe w In IN.Wikipedia. [Domena publiczna] za pośrednictwem Wikimedia Commons)
Krzywa dysocjacji oksyhemoglobiny (źródło: ratznium w angielskiej wersji Wikipedialat zostały przesłane przez Aaronsharpe w In IN.Wikipedia. [Domena publiczna] za pośrednictwem Wikimedia Commons) Rozwój coraz bardziej złożonych organizmów pluricekomórkowych sugerował, że komórki wewnętrzne zostały znacznie odciągnięte od środowiska, więc mechanizmy rozpowszechniania jako jedyne źródło zaopatrzenia stały się niewystarczające.
W ten sposób opracowano wyspecjalizowane systemy w celu uzyskania składników odżywczych i gazów, takich jak układ trawienny i układ oddechowy, a także mechanizmy transportu w celu wprowadzenia tych składników odżywczych i gazów do komórki: układ sercowo -naczyniowy.
Aby wytwarzać energię w postaci cząsteczek ATP, komórki potrzebują tlenu. W związku z faktem, że ATP nie można przechowywać, musi być stale syntetyzowany, co oznacza trwałe zapotrzebowanie na tlen przez komórki.
Pojawiła się hemoglobina, ewolucyjnie, jako transporter gazowy, który „rozwiązuje” problem transportu tlenu z środowiska do komórki.
[TOC]
Charakterystyka i struktura
Mówić o cechach i strukturze oksyhemoglobiny, należy odwoływać się do hemoglobiny, ponieważ oksyhemoglobina jest niczym więcej niż hemoglobiną tlenu. Dlatego odtąd zostaną opisane wspólne cechy cząsteczki w obecności lub nie danego gazu.
Po co hemoglobina?
Hemoglobina jest niezbędna do transportu tlenu do tkanek pod względem ilości i prędkości, z uwagi na fakt, że tlen ma tak niewielką rozpuszczalność krwi, że jego transport dyfuzyjny byłby niewystarczający do zaspokojenia potrzeb tkanek.
Może ci służyć: dowody ewolucji żywych istotJak wygląda cząsteczka hemoglobiny?
Hemoglobina jest białkiem tetramerycznym (które ma cztery podjednostki), ma sferyczny kształt i masę cząsteczkową 64 kDa.
Cztery podjednostki stanowią pojedynczą jednostkę funkcjonalną, w której każda z nich wzajemnie wpływa na drugą. Każda podjednostka składa się z łańcucha polipeptydowego, globiny i grupy protetycznej, grupy hemo lub „hem”, która działa jako kofaktor i nie jest tworzona przez aminokwasy; to znaczy, że nie jest to natura białka.
Globin jest na dwa sposoby: globina alfa i beta globin. Tetramer hemoglobiny składa się z pary łańcuchów globinowych alfa (141 aminokwasów) i kilku łańcuchów globinowych beta (146 aminokwasów).
Każdy z czterech łańcuchów polipeptydowych jest powiązany z grupą HEMO, która ma atom żelaza w stanie żelaza (Fe2+) w środku.
Jak tam grupa hemo?
Grupa HEMO jest pierścieniem porfiryny, który powstaje przez cztery pierścienie pirolowe (heterocykliczne związki aromatyczne z wzorem C4H5N) zjednoczone przez mosty metylowe. Żelazo w stanie żelaza występujące w centrum podlega strukturze poprzez skoordynowane łącza azotu.
Każda grupa hemo jest w stanie dołączyć do cząsteczki tlenu, więc każda cząsteczka hemoglobiny może łączyć tylko 4 cząsteczki gazowe.
Ciało ludzkie zawiera około 2,5 x 1013 erytrocyty, które są komórkami krwi, które wytwarzają i transportują hemoglobinę. Każdy erytrocyt ma około 280 milionów cząsteczek hemoglobiny, a następnie może transportować ponad 1000 milionów cząsteczek tlenu.
Może ci służyć: proces hominizacji: cechy i fazyJak powstaje oksyhemoglobina?
Oxihemoglobina powstaje po zjednoczeniu atomu tlenu dla każdego atomu żelaza żelaza, który znajduje się w każdej grupie hemo cząsteczki hemoglobiny.
Termin oksyhemoglobina odnosi się następnie do utlenionej, a nie chemicznie utlenionej hemoglobiny, ponieważ nie traci elektron.
Natlenienie powoduje zmianę czwartorzędowej struktury cząsteczki, to znaczy zmiana konformacji, która może być przenoszona z łańcuchów globinowych na grupę hemo i odwrotnie.
Jaka jest maksymalna ilość tlenu, który może ładować hemoglobinę?
Hemoglobina może co najwyżej połączyć cztery cząsteczki tlenu w swojej strukturze. Jeśli objętość molowa gazów idealnych wynosi 22.4 l/mol, jeden mol hemoglobiny (64.500 g) dołączy do 89.6 litrów tlenu (4 mole O2 x 22.4 l/mol).
Tak więc każdy gram hemoglobiny musi dołączyć 1.39 ml O2 jest w 100% nasycone (89.6L/64500G X (1000 ml/l)).
W praktyce badania krwi wykazują nieco niższe wyniki, ponieważ istnieją niewielkie ilości metemoglobiny (utleniona hemoglobina) i karboksyhemoglobiny (hemoglobina + montażka węgla (CO)), które nie mogą przyłączyć się do tlenu.
Biorąc to pod uwagę, zasada „Hüfnera” określa, że we krwi 1 g hemoglobiny ma maksymalną zdolność do zjednoczenia tlenu 1.34 ml.
Krzywa wiązania oksyhemoglobiny
Ilość cząsteczek tlenu, które można połączyć z cząsteczką hemoglobiny, zależy od częściowego ciśnienia tlenu lub PO2. W przypadku braku tlenu hemoglobina jest odtleniana, ale wraz ze wzrostem PO2 liczba tlenu, która wiąże się z hemoglobiną.
Proces wiązania tlenu z hemoglobiną zależną od częściowego ciśnienia tlenu. Podczas wykresu wynik nazywa się „krzywa oksymoglobiny” i ma charakterystyczną formę „s” lub sigmoid.
Może ci służyć: taksiszmW zależności od PO2 hemoglobina będzie miała mniejszą lub większą pojemność do „uwolnienia” lub „dostarczenia” tlenu, który transportuje, a także ładuje się z tym.
Na przykład w obszarze od 10 do 60 mmHg ciśnienia otrzymujesz część z większą liczbą krzywej. W tym stanie hemoglobina może łatwo uzyskać duże ilości O2. Jest to warunek osiągnięty w tkankach.
Gdy PO2 wynosi od 90 do 100 mmHg (12 do 13 kPa), hemoglobina jest prawie 100% nasycona O2; A gdy Tętnicze PO2 wynosi 60 mmHg (8 kPa), nasycenie O2 jest nadal tak wysokie jak 90%.
W płucach są to warunki, które dominują (ciśnienie między 60 a 100 mmHg), i to pozwala na obciążanie cząsteczek hemoglobiny obecnych w erytrocytach.
Ta sigmoidalna postać, która rysuje krzywą oksyhemoglobiny, zapewnia, że to białko zachowuje się jako doskonała ładowarka na poziomie płuc, bardzo wydajny przenośnik ciśnienia krwi i doskonałego dawcy O2 w tkankach, proporcjonalnie do miejscowej szybkości metabolicznej, to znaczy, to, to znaczy lokalnej szybkości metabolicznej, to domagać się.
Bibliografia
- Fox, s. Siema. (2006). Human Physiology 9th Edition (PP. 501-502). McGraw-Hill Press, New York, USA.
- Murray, r. K., Granner, zm. K., Mayes, str. DO., & Rodwell, V. W. (2014). Ilustrowana biochemia Harpera. McGraw-Hill.
- Rawn, J. D. (1998). Biochemia (1989). Burlington, Karolina Północna: Neil Patterson Publishers (c) n. Lalioti, CP Raptopoulou, a. Terzis, a. Panagiotopoulos, sperlepes i. Maness-Zouopa, J. Chem. Soc. Dalton Trans, 1327.
- Robert m. Berne, Matthew n. Nałożyć. (2001) Fizjologia. (Wyd.) Harcourt Editions, S.DO.
- West, J. B. (1991). Fizjologiczne podstawy praktyki medycznej. Williams & Wilkins
- « Charakterystyka erytropoetyny (EPO), produkcja, funkcje
- Charakterystyka dystrofiny, struktura i funkcje »

