Struktura tlenu molekularna, właściwości
- 3284
- 109
- Filip Augustyn
On Tlen molekularny albo DiOXYGEN, Nazywany również tlenem dwuatomicznym lub gazowym, jest to najczęstsza elementarna forma, w której ten element znajduje się na planecie Ziemi. Jego formuła to lub2, Dlatego będąc cząsteczką dwuatomiczną i homonuklearną, całkowicie apolarną.
Powietrze, które oddychamy, składa się z około 21% tlenu jako cząsteczki lub2. Im więcej wznosimy się, stężenia tlenu gazu zmniejszają się i zwiększają obecność ozonu, lub3. Nasze ciało wykorzystuje O2 Aby utlenić tkanki i wykonywać oddech komórkowy.
 Bez wzbogacania tlenu naszego życia atmosfery byłoby niezrównoważonym zjawiskiem. Źródło: Pixabay.
Bez wzbogacania tlenu naszego życia atmosfery byłoby niezrównoważonym zjawiskiem. Źródło: Pixabay. O2 Jest także odpowiedzialny za istnienie ognia: bez niego prawie niemożliwe byłoby posiadanie pożarów i spalania. Wynika to z faktu, że jego główną właściwością jest potężny środek utleniający, wygrywający elektrony lub zmniejszenie cząsteczki wody lub w anionach tlenkowych, lub2-.
Tlen molekularny jest niezbędny do niezliczonych procesów aerobowych, posiadania zastosowania w metalurgii, medycynie i oczyszczaniu ścieków. Gaz ten jest praktycznie synonimem ciepła, oddychania, utleniania, a z drugiej strony, zamrożonych temperatur, gdy ma on w stanie ciekłym.
[TOC]
Struktura tlenu molekularnego
 Gaza struktury molekularnej tlenu. Źródło: Benjah-BMM27 przez Wikipedia.
Gaza struktury molekularnej tlenu. Źródło: Benjah-BMM27 przez Wikipedia. Na górnym obrazie mamy strukturę cząsteczkową tlenu gazowego reprezentowaną z kilkoma modelami. W dwóch ostatnich cechy wiązania kowalencyjnego, które utrzymuje atomy tlenu, są udowodnione: podwójne wiązanie O = O, w którym każdy atom tlenu uzupełnia okett walencji.
Może ci służyć: diastreomerCząsteczka lub2 Jest liniowy, homonuklearny i symetryczny. Jego podwójne wiązanie ma długość 121 pm. Ta niewielka odległość powoduje, że wymagana jest pewna znaczna energia (498 kJ/mol), aby przełamać link o = o, a zatem jest stosunkowo stabilną cząsteczką.
Jeśli tak, tlen atmosfery całkowicie zdegradowałby się z czasem, w przeciwnym razie powietrze nic nie zapaliłoby.
Nieruchomości
Wygląd fizyczny
Tlen molekularny to bezbarwny, bez smaku i bezwonny gaz, ale podczas kondensacji i krystalizacji nabywa niebieskawe tony.
Masa cząsteczkowa
32 g/mol (zaokrąglona wartość)
Temperatura topnienia
-218 ° C
Punkt wrzenia
-183
Rozpuszczalność
Tlen molekularny nie jest zbyt rozpuszczalny w wodzie, ale wystarczający do wsparcia fauny morskiej. Gdyby Twoja rozpuszczalność była większa, mniej prawdopodobne byłoby umrzeć z powodu utonięcia. Z drugiej strony jego rozpuszczalność jest znacznie większa w olejkach i cieczach apolowych, będąc w stanie je powoli utleniać, a tym samym wpływać na ich pierwotne właściwości.
Stany energetyczne
Tlen molekularny jest substancją, której nie można całkowicie opisać przez teorię łącza Valencia (TEV).
Elektroniczna konfiguracja tlenu jest następująca:
[On] 2S² 2p⁴
Ma parę brakujących elektronów (lub :). Gdy znaleziono dwa atomy tlenu, są one powiązane z utworzeniem podwójnego wiązania O = O, uzupełniając oba okrycie Walencji.
Dlatego cząsteczka lub2 Powinien być diamagnetyczny, z wszystkimi sparowanymi elektronami. Jest to jednak cząsteczka paramagnetyczna, co tłumaczy się schematem jej orbitali molekularnych:
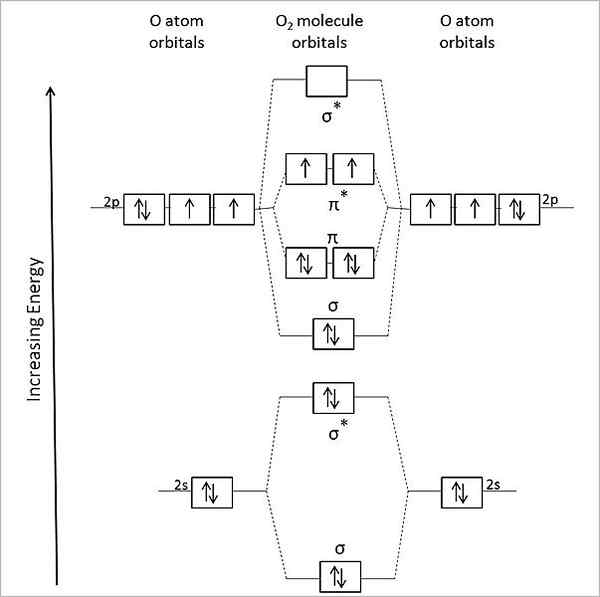 Molekularny schemat orbity dla tlenu gazowego. Źródło: Anthony.Sebastian/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
Molekularny schemat orbity dla tlenu gazowego. Źródło: Anthony.Sebastian/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Zatem molekularna teoria orbitalna (tom) lepiej opisuje OR2. Dwa brakujące elektrony znajdują się w orbitalach molekularnych π*, o większej energii i nadaj tlen z ich paramagnetycznym charakterem.
Może ci służyć: metyloamina: struktura, właściwości, produkcja, zastosowaniaW rzeczywistości ten stan energetyczny odpowiada tlenu trypletowym, 3ALBO2, Najbardziej dominujący ze wszystkich. Innym stanem energetycznym tlenu, mniej obfitym na Ziemi, jest singlem, 1ALBO2.
Transformacje
Tlen molekularny jest znacznie stabilny, o ile nie kontaktuje się z żadną substancją podatną na utlenianie, a tym bardziej, jeśli nie ma bliskiego źródła intensywnego ciepła, jak iskra. To dlatego, że o2 Ma wysoką tendencję do zmniejszania, zysku elektronów z innych atomów lub cząsteczek.
Po zmniejszeniu jest w stanie ustalić szerokie spektrum linków i kształtów. Jeśli tworzy wiązania kowalencyjne, zrobi to z mniejszą ilością atomów elektroonegatywnych niż on, w tym wodorem, aby powstać wodę, H-O-H. Może to być również wszechświat węglowy, aby spowodować wiązania C-O i kilka rodzajów natlenionych cząsteczek organicznych (Éteres, ketony, aldehydes itp.).
O2 Możesz także zdobyć elektrony, aby przekształcić nadtlenki i nadtlenki, lub22- I2-, odpowiednio. Kiedy staje się nadtlenek w organizmie, uzyskuje się nadtlenek wodoru2ALBO2, H-O-O-H, szkodliwy związek, który jest przetwarzany przez działanie określonych enzymów (peroksydazy i katali).
Z drugiej strony, a nie tylko o2 reaguje z materią nieorganiczną, aby stać się anionem tlenku, lub2-, komponowanie niekończącej się listy mas mineralogicznych, które puchną kory i płaszcz lądowy.
Aplikacje
Spoiny i spalanie
 Tlen służy do spalania acetylenu i rozpalania płomienia intensywnego ciepła, który jest cenny w spoinach. Źródło: Sheila/CC przez (https: // creativeCommons.Org/licencje/według/2.0)
Tlen służy do spalania acetylenu i rozpalania płomienia intensywnego ciepła, który jest cenny w spoinach. Źródło: Sheila/CC przez (https: // creativeCommons.Org/licencje/według/2.0) Tlen służy do przeprowadzenia reakcji spalania, za pomocą której substancja jest egzotermicznie oddawana. Ten ogień i jego temperatura różnią się w zależności od płonącego substancji. Zatem można uzyskać bardzo gorące płomienie, takie jak acetylen (powyżej), z którymi spawane są metale i stopy.
Może ci służyć: entalpiaJeśli nie w przypadku tlenu, paliwa nie mogłyby spalić i zapewnić całą swoją kaloryczną energię, używaną do zdejmowania rakiet lub uruchamiania samochodów.
Środek utleniający w zielonej chemii
Dzięki temu gazowi niekończące się tlenki organiczne i nieorganiczne są syntetyzowane lub produkowane przemysłowo. Reakcje te oparte są na mocy utleniającej tlenu cząsteczkowego, będąc również jedną z najbardziej żywotnych odczynników zielonej chemii do uzyskiwania produktów farmaceutycznych.
Wspomagane oddychanie i oczyszczanie ścieków
Tlen jest niezbędny do zaspokojenia zapotrzebowania na oddech u pacjentów z poważnymi stanami zdrowia, u nurków, gdy schodzą na niskich głębokościach, oraz u wspinaczy górskich, na których wysokości stężenie tlenu wygląda radykalnie zmniejszone.
Podobnie tlen „karmi” bakterie aerobowe, które pomagają degradować odpady ze ścieków lub pomagają oddychać rybami, w uprawach wodnych w celu ochrony lub handlu.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Alotropy tlenu. Źródło: w:.Wikipedia.org
- Hone, c.DO., Kappe, c.ALBO. (2019). Zastosowanie tlenu cząsteczkowego do utleniania tlenowych w fazie ciekłej w ciągłym przepływie. Top Curr Chem (Z)377, 2. doi.Org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28 stycznia 2020). 10 zastosowań tlenu. Odzyskane z: naukowe.com
- Fiszki. (2020). Biochemia I: Chemia tlenu molekularnego. Odzyskane z: cliffsnotes.com
- Zabezpieczenia przemysłowe GZ. (2020). Korzyści przemysłowe gazu tlenu. Źródło: GZ-Supplies.com
- « Kultura tradycji portugalnych, zwyczajów, gastronomii, religii
- Niszczycielski wzór i równania, przykłady, ćwiczenia »

