Struktura szczawianu sodu (Na2C2O4), właściwości, zastosowania, ryzyko

- 3679
- 1128
- Filip Augustyn
On szczawian sodu Jest to związek organiczny utworzony przez dwa jony sodu i jon szczawianu. Jego formuła chemiczna to Na2C2ALBO4 lub także na2(GRUCHAĆ)2. Jest sól sodową kwasu szczawiowego lub kwasu etanodioinowego. Następnie2C2ALBO4 Jest krystaliczną białą substancją stałą, a jego wodne roztwory są podstawowe (alkaliczne).
Szczawian sodu jest obecny w roślinach i warzywach. W ludzkiej istocie jest wytwarzany naturalnie z sprzężonego kwasu kwasu szczawiowego, który z kolei jest wytwarzany przez niektóre procesy metaboliczne.
 Szczawian sodu na2(GRUCHAĆ)2 solidny. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons.
Szczawian sodu na2(GRUCHAĆ)2 solidny. LEM [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)]. Źródło: Wikimedia Commons. Następnie2C2ALBO4 Jest stosowany w laboratoriach analizy chemicznej jako środek redukujący (przeciwieństwo utleniacza). Także umożliwić testy niektórych związków organicznych podczas oczyszczania ścieków.
Został zastosowany do eliminacji odpadów chlorofluorokarbonów (CGC), które uszkadzają warstwę ozonową. Jest również surowcem do uzyskania kwasu szczawiowego w sposób ekonomiczny.
Ze względu na wysoką zawartość szczawianu sodu w niektórych jadalnych warzywach ludzie, którzy mają tendencję do tworzenia obliczeń lub kamieni nerkowych, powinni unikać spożywania takich pokarmów. Wynika to z faktu, że kamienie są ogólnie tworzone z szczawianami.
[TOC]
Struktura
Szczawian sodu składa się z dwóch kationów sodu+ i anion szczawiany (COO)22-. Anion szczawianowy powstaje z kolei przez dwa COO- dołączył do dwóch atomów węgla: -Ooc-COO-.
W stałym szczawianie sodu anion szczawianowy ma płaski kształt. Oznacza to, że zarówno węgle, jak i tlen znajdują się w tej samej płaszczyźnie.
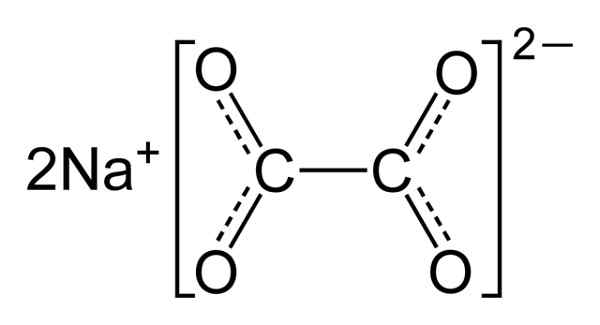 Struktura chemiczna szczawianu sodu2(GRUCHAĆ)2. Autor: Benjah-BMM27. Źródło: Wikimedia Commons.
Struktura chemiczna szczawianu sodu2(GRUCHAĆ)2. Autor: Benjah-BMM27. Źródło: Wikimedia Commons. Nomenklatura
- Szczawian sodu
- Dysodio szczawian
- Sól sodu kwasu etanodioinowego
Nieruchomości
Stan fizyczny
Krystaliczna biała stała.
Waga molekularna
134,0 g/mol
Gęstość
2,27 g/cm3 w 20 ° C.
Rozpuszczalność
Rozpuszczalna w wodzie: 3,7 g/100 ml w 20 ° C.
Ph
Jego wodne roztwory są podstawowe (alkaliczne), ponieważ anion szczawianowy ma tendencję do przyjmowania protonów wody, pozostawiając jony OH za darmo-.
Może ci służyć: neon: historia, właściwości, struktura, ryzyko, użyciaWłaściwości chemiczne
Może zneutralizować kwasy, a reakcje są egzotermiczne, to znaczy wydzielają ciepło.
Służy jako środek redukujący, aw tych reakcjach generuje dwutlenek węgla CO2.
Ma własność łączenia się z kilkoma jonami metali, takimi jak wiara jonów żelaza żelaza2+ i wiara żelaza3+.
Uzyskanie
Według konsultacji źródła szczawianu sodu można uzyskać utleniając tlen lub2 W temperaturze około 250 ° C w stężonym roztworze wodorotlenku sodu NaOH.
Obecność w naturze
Szczawian sodu jest obecny w wielu roślinach i warzywach, takich jak chard, szpinak i ruibarbo, oraz w ziarnach, takich jak soja, wśród wielu innych produktów roślinnych.
 Szpinak ma dużo szczawianu sodu. Autor: ALine Ponce. Źródło: Pixabay.
Szpinak ma dużo szczawianu sodu. Autor: ALine Ponce. Źródło: Pixabay. Jego sprzężony kwas kwasowy szczawiowy występuje w ludzkim organizmie przez metabolizm kwasu glikolowego lub kwasu askorbinowego. Po wyprodukowaniu nie jest metabolizowany, ale jest wydalany przez mocz w kształcie szczawianu.
 Ruibarbo zawiera szczawianu sodu. Autorzy: s. Hermann i F. Richter. Źródło: Pixabay.
Ruibarbo zawiera szczawianu sodu. Autorzy: s. Hermann i F. Richter. Źródło: Pixabay. Aplikacje
W laboratoriach analizy chemicznej
Jest stosowany jako odczynnik chemiczny, zwykle jako środek redukujący, na przykład do standaryzacji roztworów permangananowych potasowych, to znaczy dokładnie ustalenia, ile mają nadmanganianu sodu.
W zniszczeniu chlorofluorokarbonów
Do niszczenia chlorofluorokarbonów (CFC) zastosowano szczawian sodu (CFC). Te związki CFC były jednym z osób odpowiedzialnych za zniszczenie warstwy ozonowej planety (która chroni nas przed promieniowaniem ultrafioletowym).
W 1996 r. Niektórzy badacze zaproponowali zastosowanie szczawianu sodu w celu ich wyeliminowania, ponieważ łatwo reaguje on z CFC w temperaturach 270-290 ° C, co czyni je nieszkodliwymi produktami w kierunku warstwy ozonowej.
Reakcję szczawianu sodu z CFC można kontrolować w celu uzyskania fluorowconych węglowodorów aromatycznych, które nie są szkodliwe dla warstwy ozonowej, ale są przydatnymi związkami w przemyśle chemicznym.
Może ci służyć: glikol propylenowy: struktura, właściwości, synteza i zastosowaniaTa reakcja można również doprowadzić do maksimum i przekształcić cały CFC w fluorku sodu NAF, chlorku sodowego, elementarnego węgla i dwutlenku węgla CO2.
 Warstwa ozonowa planety chroni nas przed promieniami ultrafioletowymi słońca. Szczawian sodu pozwala wyeliminować związki CFC, które go uszkadzają. Autor: One94. Źródło: Pixabay.
Warstwa ozonowa planety chroni nas przed promieniami ultrafioletowymi słońca. Szczawian sodu pozwala wyeliminować związki CFC, które go uszkadzają. Autor: One94. Źródło: Pixabay. Przy określaniu ważnych parametrów w oczyszczaniu ścieków
Stwierdzono, że szczawian sodu jest przydatny do pomiaru ilości i klas związków organicznych, które wydzielają mikroorganizmy szlamu stosowane do przetwarzania ścieków.
Miara takich związków jest ważna dla określenia ich funkcji podczas oczyszczania ścieków, ponieważ zależy od nich łatwość oddzielenia błota od wody.
Za pomocą szczawianu sodu unika się niedogodności innych metod.
Aby uzyskać kwas szczawiowy
Surowy szczawian sodu z odpadów z niektórych procesów został wykorzystany do wytworzenia kwasu szczawiowego H2C2ALBO4 w wielkich ilościach.
Metoda wykorzystuje szlam z procesu Bayera do leczenia boksytu (minerał aluminiowy). W procesie Bayera boksyt jest traktowany wodorotlenkiem sodu NaOH w celu rozpuszczenia tlenku glinu tego minerału.
W procesie rozpuszczania tlenu tlenu niektóre związki organiczne obecne w minerałach, takie jak kwasy humusowe, są atakowane przez NaOH, wytwarzając dużą ilość szczawianu sodu na2C2ALBO4.
Ten szczawian sodu jest włączony do błota z związkami aluminiowymi. Aby go oczyszczyć, zespół jest rozpuszczony, jest filtrowany i przepuszczany przez kolumnę wymiany jonów kwasowych.
W kolumnie znajduje się żywica kwasu sulfonowego RSO3H gdzie wymieniane są jony metaliczne+ przez jony wodoru h+, Więc otrzymujesz kwas szczawiowy h2C2ALBO4.
RSO3H + na2C2ALBO4 ⇔ RSO3Na + nahc2ALBO4
Może ci służyć: węglan potasowy (K2CO3): struktura, właściwości, użycie, uzyskiwanieRSO3H + Nahc2ALBO4 ⇔ RSO3Na + h2C2ALBO4
Jest to proces gospodarczy, a uzyskany kwas szczawiowy ma akceptowalną czystość.
Usunąć niechciane związki
Skoniugowany kwas szczawianu sodu, kwas szczawiowy H2C2ALBO4, Służy do rozpuszczenia niektórych rodzajów odpadów i inkrustacji.
Kwas szczawiowy charakterystyczny w celu uzyskania szczawianu jest stosowany jako złożony lub wytrący czynnik na przykład podczas przetwarzania odpadów z różnych paliw jądrowych.
Kwas szczawiowy jest również stosowany do usuwania wkładek minerałów i tlenków żelaza w rurach i innych urządzeniach, wynika to z jego zdolności do silnego połączenia się z wiarą jonów żelaznych2+ jak wiara żelaza3+ tworzenie szczawianów.
Ryzyko
Jeśli szczawian sodu jest wdychany lub połknięty bezpośrednio. Powoduje wymioty, ciężkie oczyszczenie, słaby puls, zawalenie się sercowo -naczyniowe, objawy nerwowo -mięśniowe i uszkodzenie nerek.
Osoby, które mają tendencję do tworzenia obliczeń w nerkach z powodu akumulacji szczawianu w moczu, powinny unikać spożywania warzyw o wysokiej zawartości rozpuszczalnych szczawian.
Szczawian sodu w dużych ilościach w żywności podczas osiągnięcia moczu wiąże się z obecnym wapniem i może wytwarzać obliczenia lub kamienie szczawianu wapnia w nerkach dla osób, które mają tendencję do tego.
 Szczawian sodu niektórych pokarmów może prowadzić do tworzenia kamieni w nerkach osób z predyspozycją. Autor: Azwer. Źródło: Pixabay.
Szczawian sodu niektórych pokarmów może prowadzić do tworzenia kamieni w nerkach osób z predyspozycją. Autor: Azwer. Źródło: Pixabay. Bibliografia
- LUB.S. National Library of Medicine. (2019). Szczawian sodu. National Center for Biotechnology Information. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Chai, w. I Liebman, m. (2005). Wpływ różnych metod gotowania na zawartość szczawianu warzywnego. J. Rolnictwo. Żywność Chem. 2005, 53, 3027-3030. Odzyskane z pubów.ACS.org.
- Dagani, r. (1996). CFC niszczy REION. Chemical & Engineering News Archive 1996, 74, 4, 6-7. Odzyskane z pubów.ACS.org.
- Sajad, m. i Kim, K.S. (2016). Ekstrakcja zewnątrzkomórkowych substancji polimerowych z szlamu aktywowanego za pomocą szczawianu sodu. Int. J. Środowisko. Sci. Technol. 13, 1697-1706 (2016). Link odzyskał.Skoczek.com.
- Jeffrey, g.DO. I Parry, G.S. (1954). Struktura krystaliczna szczawianu sodu. J. JESTEM. Chem. Soc. 1954, 76, 21, 5283-5286. Odzyskane z pubów.ACS.org.
- Okuwaki, a. i in. (1984). Produkcja szczawianu przez utlenianie węgla z tlenem w skoncentrowanym roztworze wodorotlenku sodu. Ind. Eng. Chem. Szturchać. Wołowina. Dev. 1984, 23, 648-651. Odzyskane z pubów.ACS.org.
- Hefter, g. i in. (2018). Rozpuszczalność szczawianu sodu w stężonych roztworach elektrolitowych. J Dane Chem & Eng. 2018, 63, 3, 542-552. Odzyskane z pubów.ACS.org.
- La k. Siema. (1992). Proces przygotowania kwasu szczawiowego i szczawianu wodoru sodu z surowego szczawianu sodu. LUB.S. Patent nr 5 171 887. Dec.15, 1992. Pobrano z Freepatentssonline.com.
- « HAPTES HISTORIA, FUNKCJE, CHARAKTERYSTYKA, INMUNES ODPOWIEDZI
- Struktura Tripolifosforan Sodu (Na5P3O10), właściwości, zastosowania, uderzenie »

