Brak historii metali, właściwości, grup, użycia

- 1894
- 264
- Eliasz Dubiel
Brak metali Są to grupa elementów zlokalizowanych po prawej stronie stolika okresowego, z wyjątkiem wodoru zlokalizowanego w grupie 1 (AI), wraz z metaliami alkalicznymi. Jeśli chcesz wiedzieć, jakie są, musisz spojrzeć na prawy górny róg bloku P.
Atomy niemetalne są stosunkowo małe, a ich zewnętrzna warstwa elektroniczna ma podwyższoną liczbę elektronów. Wśród elementów niemetalicznych można znaleźć stałe, ciecze i gazy; Chociaż są głównie w stanie gazowym, kilka z nich wzbogacało atmosferę.
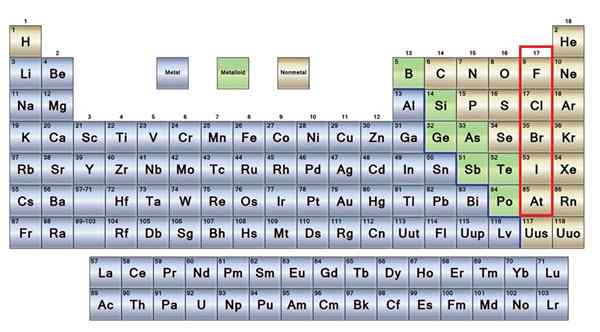 Elementy nie -metalowe w brązowym
Elementy nie -metalowe w brązowym Dobra część nie -metalów jest obecna we wszystkich żywych istotach w postaci związków i makrocząsteczek. Na przykład: węgiel, tlen i wodór są obecne we wszystkich białkach, lipidach, węglowodanach i kwasach nukleinowych.
Fosfor jest obecny we wszystkich kwasach nukleinowych oraz w niektórych węglowodanach i lipidach. Siarka występuje w wielu białkach. Azot jest częścią wszystkich kwasów nukleinowych i białek.
Z drugiej strony, podziemne, gazy metanowe i surowe ropy są prawie składane z elementów niemetalicznych. W rzeczywistości węglowodory (węgiel i wodór) dają wyobrażenie o tym, jak obfite są nieMetale, pomimo mniejszej liczby pierwiastków w tabeli okresowej.
[TOC]
Historia
Od starożytności (3750 do.C.) Egipcjanie używali węgla, aby zmniejszyć miedź obecną w swoich minerałach, takich jak Corvelita i Malachit.
W 1669 r. Henry Cavendish (1776) osiągnął identyfikację wodoru, chociaż kilku badaczy, w tym Robert Boyle (1670), wytwarzało wodór poprzez reakcję silnego kwasu z metalem.
Carl Scheele wytwarzał tlen przez ogrzewanie tlenku rtęci z azotanami (1771). Curtois zdołał odizolować jod, próbując przygotować saletki z wodorostów (1811). Balard i Gmelin izolowali Bome (1825).
W 1868 roku Janssen i Lockger Independent. Moissanowi udało się izolować fluor (1886).
W 1894 r. Lord Rayleigh i Ramsey odkryli Argona, badając właściwości azotu. Ramsay i Travers (1898) wyizolowali krypton, neon i ksenon płynnego argonu, przez kriogeniczną destylację powietrza.
Fizyczne i chemiczne właściwości
 Siarka jest jednym z najbardziej reprezentatywnych elementów niemetalicznych. Źródło: Ben Mills przez Wikipedia.
Siarka jest jednym z najbardziej reprezentatywnych elementów niemetalicznych. Źródło: Ben Mills przez Wikipedia. Fizyczny
Niektóre z fizycznych właściwości innych niż metal to:
-Mają niską przewodność elektryczną, z wyjątkiem węgla w postaci grafitu, który jest dobrym przewodnikiem energii elektrycznej.
Może ci służyć: heptano (C7H16): struktura, właściwości i zastosowania-Mogą wystąpić pod fizycznym wyglądem ciał stałych, cieczy lub gazów.
-Mają niską przewodność cieplną, z wyjątkiem węgla w postaci diamentu, który nie zachowuje się jak izolator termiczny.
-Mają mały połysk, w przeciwieństwie do metalowej jasności.
-Niezelegalne stałe są kruche, więc nie są plastyczne ani plastyczne.
-Mają niskie punkty topnienia i wrzenia.
-Mogą prezentować różne struktury krystaliczne. Zatem fosfor, tlen i fluorki mają sześcienną strukturę krystaliczną; Wodór, węgiel i azot, sześciokąta; oraz siarka, chlor, brom i jod, ortorombowy.
Chemia
Nie metale charakteryzują się wysoką energią jonizacyjną i wysoką wartością elektroonegatywności. Na przykład fluor ma największą elektrooniczność (3,98), będąc najbardziej reaktywnym elementem innych niż metal.
Ale zaskakujące, że Hele Gases Hel (5.5) i Neon (4,84) mają największą elektrooniczność. Są jednak chemicznie obojętne, ponieważ pełne warstwy elektroniczne zewnętrzne.
Nie metali tworzą związki jonowe z metali i kowalencyjne z niemetalami.
Elementy niemetaliczne tworzą cząsteczki dwuatomiczne, połączone wiązaniami kowalencyjnymi. Tymczasem atomy gazów szlachetnych są w postaci jednostek atomowych.
Tworzą tlenki kwasowe, które reagują z wodą, pochodzą kwasy.
Grupy bez metalowych i elementów

Grupa 1
Jest składany przez wodór bezbarwny i toaletowy gaz, dialotomiczny. Stan utleniania +1. Ma mniej gęstości niż powietrze. W stanie stałym przedstawia sześciokątną strukturę krystaliczną. Wodór jest małym elementem reaktywnym.
Grupa 14
Węgiel jest jedynym nie -metalowym należącym do tej grupy. Węgiel w postaci grafitu jest lśniąca stała, z sześciokątną strukturą krystaliczną. Ma wysoką przewodność elektryczną. Jego najczęstsze stany utleniania wynoszą +2 i +4.
Grupa 15
Azot
Bezbarwny i toaletowy gaz. Jest to trochę element reaktywny i nieco gęstszy niż powietrze. Bardziej powszechne stany utleniania: -3 i +5. Tworzą cząsteczki diatomowe, n2.
Mecz
Solidny, jego kolor może być biały, żółty lub czarny. Mały reaktywny. ORTORBORBIC Crystalline Struktura. Elektroniarzność 2,1. Bardziej powszechne stany utleniania: -3 i +5.
Grupa 16
Tlen
Bezbarwny gaz lub jasnoniebieski toalet. Ogólnie nie reaktywne. Sześcienna struktura krystaliczna. Jest izolatorem i silnym środkiem utleniającym. Electronegativity 3.5. Stan utleniania -2
Siarka
Jasnożółty stał, krucha, umiarkowanie reaktywna. ORTORBORBIC Crystalline Struktura. Tworzą kowalencyjne obligacje. Electronegativity 2.5. Bardziej powszechne stany utleniania: -2, +2, +4 i +6.
Selen
Czarny szary lub czerwonawo. Grey Selenium pokazuje światło wrażliwe na przewodność elektryczną. Jest to miękka i krucha stała. Electronegativity 2.4. Stany utleniania: -2, +2, +4 i +6.
Może ci służyć: wodorotlenek potasu: struktura, właściwości, zastosowaniaGrupa 17
Fluor
Jest to jasnożółty gaz, bardzo toksyczny. Jest to bardzo reaktywny element. Jest przedstawiany jako cząsteczki dwuatomiczne, F2. W stanie stałym krystalizuje w postaci sześciennej. Electronegativity 3.98. Stany utleniania -1.
Chlor
To jest zielono-żółty gaz. Przedstawia cząsteczki dwuatomiczne, Cl2. Jest bardzo reaktywny. W stanie stałym struktura krystaliczna jest ortorombowa. Electronegativity 3.0. Stany utleniania: - 1, +1, +3, +5, +7.
Brom
Jest to płyn czerwony. Elektroniarzność 2.8. Stany utleniania -1, +1, +3, +5 i +7.
Jod
Jest czarną substancją subtelną, że gdy jest sublimaty, emituje fioletową parę. ORTORBORBIC Crystalline Struktura. Metalowe joddy są jonowe. Electronegativity 2.5. Stany utleniania: -1, +1, +3, +5, y +7.
Astato
To czarna substancja stała. Sześcienna struktura krystaliczna wyśrodkowana na twarzy. Elektroniarzność 2,2. Jest to słaby środek utleniający.
Grupa 18
Hel
Ma wysoką przewodność cieplną. Electronegativity 5.5. Jest chemicznie obojętny i nie jest łatwopalny. Niska gęstość i wysoka płynność.
Neon
Wysoka zdolność chłodzenia w stanie ciekłym. Elektroniarzowość 4.84. Jest to najmniej reakcyjny dla szlachetnych gazów.
Argon
Jest gęstszy niż powietrze. Chemicznie obojętny. Electronegativity 3.2.
Krypton
Electronegativity 2.94. Może reagować z fluorkiem z tworzeniem dyfluorku kryptona (KRF2).
Ksenon
Przekracza barierę mózgową krwi. Odpowiada na światło wytwarzające prąd elektryczny. Elektroniarzność 2,2. Złożona postać z fluorem, złotem i tlenem.
Radon
To element radioaktywny. Electronegativity 2.06. Tworzą związki z fluorem (RNF2) i z tlenem (RNO3).
Aplikacje
Wodór

Jest stosowany w napędu rakietowym i jako paliwo w silnikach samochodowych, które wykorzystują wodór. Jest stosowany w syntezie amoniaku (NH3) i w uwodornieniu tłuszczów.
Węgiel
Grafit jest używany w produkcji ołówków i włókien o wysokiej odporności, które są używane w opracowywaniu artykułów sportowych. Diament jest używany jako klejnot o wielkiej wartości, a ćwiczenia wiertnicze jako ścierne. Dwutlenek węgla jest stosowany w opracowaniu napojów bezalkoholowych.
Azot
Jest stosowany w produkcji amoniaku, kwasu azotowego i mocznika. Azot jest niezbędnym elementem dla roślin i jest stosowany w produkcji nawozów.
Mecz
Biały fosfor jest stosowany jako raticide, insektycyd i w przemyśle pirotechnicznym. Czerwony fosfor jest stosowany w meczach produkcyjnych. Jego związki są również stosowane w opracowywaniu nawozów.
Tlen
Tlen jest stosowany w opracowywaniu stali, tworzyw sztucznych i tekstyliów. Jest również stosowany w rakietach, terapii tlenowej i pomocy oddechowej w samolotach, okrętach podwodnych i lotach kosmicznych.
Może ci służyć: erbio: struktura, właściwości, uzyskiwanie, użyciaSiarka
Jest stosowany jako surowiec do produkcji kwasu siarkowego, prochu i wulkanizacji gumów. Sulfity są używane do wybielacza papieru i fungicydu.
Selen
Służy do przekazania szkarłatnej czerwonej zabarwienia szklanemu. Służy również do zneutralizowania zielonkawych niuansów wytwarzanych przez zanieczyszczenie szkła za pomocą związków żelaza. Jest stosowany w komórkach fotoelektrycznych z zastosowaniem na drzwiach i windach.
Fluor

Jest dodawany do kremów dentystycznych, aby zapobiec próchnicy. Fluor wodoru jest stosowany jako surowiec do teflonu. Fluor monoatomowy stosuje się do produkcji półprzewodników.
Chlor
Jest stosowany w metalurgii ekstrakcyjnej i chlorowaniu węglowodorów do produkcji różnorodnych produktów, takich jak PVC. Chlor jest używany w wybielaniu miazgi drewna i tekstylnego. Jest również stosowany jako środki dezynfekujące wodę.
Brom
Jest stosowany w przygotowaniu srebrnego bromku do jasnych soczewek i w filmach fotograficznych, stosuje się również w opracowaniu uspokajającego bromku sodu i dibrometanu, przeciwdno -niedomina benzyny.
Jod
Dodaje się jodek potasu (KI), aby zapobiec worek tarczycy. Nalezja jodu jest stosowana jako antyseptyczny i germicyd. Jod jest częścią hormonów tarczycy.
Hel
Jest stosowany w napełnieniu balonów na gorące powietrze i zmieszany z tlenem do oddychania głębokiej wody. Służy do spoin w obojętnej atmosferze i pomaga utrzymać bardzo niskie temperatury badawcze.
Neon
W szklanych rurach, które zapalają się na działanie elektryczności (neonowe czerwone światła).
Argon
Służy do tworzenia atmosfery do spawania i w wypełnieniu reflektorów w Nagrandescencji.
Ksenon
Mieszanka ksenonu i kryptonu jest używana do produkcji błysków o dużej intensywności na krótkoterminowej wystawie fotograficznej.
Radon
Jest stosowany w leczeniu guzów nowotworowych przez radioterapię.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Mathews, c. K., Van Holde, K. I. I ahern, k. G. (2002). Biochemia. Trzecia edycja. Edytować. Pearson-Addison Wesley
- Helmestine, Anne Marie, pH.D. (6 października 2019). Jakie są właściwości niemetali? Odzyskane z: Thoughtco.com
- Wikipedia. (2019). Niemetal. Źródło: w:.Wikipedia.org
- Redaktorzy Enyclopaedia Britannica. (5 kwietnia 2016). Niemetal. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Jose m. Gavira Vallejo. (27 stycznia 2016 r.). Jakie są pnicogeny? I ICosogenos, Crystalogens, Calcogeny .. ? Źródło: Triplenlace.com
- « Historia fluoru, właściwości, struktura, uzyskiwanie, ryzyko, zastosowania
- Co to jest, typy i cechy »

