Historia fluoru, właściwości, struktura, uzyskiwanie, ryzyko, zastosowania
- 4670
- 504
- Prokul Woliński
On fluor Jest to element chemiczny reprezentowany z symbolem F i główki Grupa 17, do którego należą halogeny. Wyróżnia się nad innymi elementami stolika okresowego, ponieważ jest najbardziej reaktywnym i elektroungatywnym; reaguje prawie ze wszystkimi atomami, więc tworzy niezliczone sole i związki organizacyjne.
W normalnych warunkach jest to jasnożółty gaz, który można pomylić z żółtawą zielenią. W stanie ciekłym, pokazanym na dolnym obrazie, jego żółty kolor nasila się nieco, co znika całkowicie, gdy zestala się w punkcie zamrażania.
 Ciekła fluor w rurce testowej. Źródło: Fulvio314 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)]
Ciekła fluor w rurce testowej. Źródło: Fulvio314 [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] Jest to taka reaktywność, pomimo niestabilnego gazu, który pozostaje złapany w skorupę Ziemi; szczególnie w postaci fluorytowej minerału, znanego z fioletowych kryształów. Podobnie jego reaktywność sprawia, że jest to potencjalnie niebezpieczna substancja; Reaguj energicznie ze wszystkim, co dotyka i płonie płomienie.
Jednak wiele jego pochodnych produktów może być nieszkodliwe, a nawet korzystne, w zależności od ich zastosowań. Na przykład najpopularniejsze zastosowanie fluoru, dodane w postaci jonowej lub mineralnej (takiej jak sole fluorowe), składa się z przygotowania pasów dentystycznych fluorkiem, które pomagają chronić szkodę zębów.
Fluor przedstawia osobliwość, że wysokie liczby lub stany utleniania mogą ustabilizować dla wielu innych pierwiastków. Im większa liczba atomów fluorowych, tym bardziej reaktywny będzie związek (chyba że jest to polimer). Podobnie jego efekty z matrycami molekularnymi wzrosną; na lepsze lub gorsze.
[TOC]
Historia
Stosowanie fluorytów
W 1530 r. Niemiecki mineralogista Georgius Agricola odkrył, że w oczyszczaniu metali Fluorspar może być stosowany. Fluorpar to inna nazwa fluorytów, minerału fluorowego, który składał się z fluorku wapnia (CAF2).
Element fluorowy nie został do tego czasu odkryty, a „fluoir” w fluorytu pochodzi od łacińskiego słowa „fluere”, co oznacza „przepływ”; Ponieważ to właśnie zrobił fluorski lub fluoryt z metali: pomógł im opuścić próbkę.
Przygotowanie kwasu fluorowego
W 1764 r. Andreas Sigismud Margraff zarządzał. Szkło powraca stopione przez działanie kwasu, więc szkło zastąpiło metale.
Jest również przypisywany Carl Scheele w 1771 r., Przygotowanie kwasu tą samą metodą, a następnie Margraff. W 1809 r. Francuski naukowiec Andre-Marie Ampere zaproponował, że kwas fluorowy lub fluorowy był związkiem utworzonym przez wodór i nowy element podobny do chloru.
Naukowcy przez długi czas próbowali izolować fluorę poprzez stosowanie kwasu fluorhorycznego; Ale jego niebezpieczeństwo poczyniło postępy w tym względzie.
Humphry Davy, Joseph Louis Gay-Lussac i Jacques Thénard mieli silny ból podczas wdychania fluoru wodoru (kwas fluorkowy bez wody i w postaci gazowej))))))))))). W podobnych okolicznościach naukowcy Paulin Louyet i Jerome Nickles zmarli przez zatrucie.
Edmond Fréme, francuski badacz, próbował stworzyć suchy kwas fluorhorydowy, aby uniknąć toksyczności fluoru wodoru przez zakwaszenie bifluorku potasu (KHF2), Ale podczas elektrolizy nie było przewodzenia prądu elektrycznego.
Izolacja
W 1860 roku angielski chemik George Gore wypróbował. Jednak nastąpiła eksplozja przez gwałtownie rekombinację wodoru za pomocą fluoru. Gore przypisał eksplozję wycieku tlenu.
W 1886 r. Wcześniej praca Moissona została przerywana czterokrotnie z powodu poważnego zatrucia fluorkiem wodoru, próbując izolację elementu.
Moisson był studentem fony i był oparty na jego eksperymentach na izolowanie fluoru. Moisson stosowany w elektrolizy mieszanina fluoru potasowego i kwasu fluorhorowego. Powstały roztwór prowadził energię elektryczną i gaz fluorowy zgromadził anodę; to znaczy w pozytywnie obciążonej elektrodzie.
Moisson zastosował sprzęt oporny na korozję, w którym elektrody były wykonane z platyny i stopu irydowego. W elektrolizy zastosowano pojemnik platyny i ochłodził roztwór elektrolityczny w temperaturze -23 ° F (-31 ° C).
Wreszcie, 26 czerwca 1886 r., Henri Moissonowi udało się odizolować fluor, który pozwolił mu wygrać Nagrodę Nobla w 1906 roku.
Zainteresowanie fluorem
Przez jakiś czas zainteresowanie badaniem fluoru zostało utracone. Jednak rozwój projektu na Manhattanie na produkcję bomby atomowej.
Amerykańska firma Dupont rozwinęła się w latach 1930–1940, produkty fluorowane, takie jak chlorofluorowęglany (Freon-12), stosowane jako czynniki chłodnicze; i plastik politrafluoroetylenu, znany najlepiej z nazwą Teflon. To spowodowało wzrost produkcji i konsumpcji fluorowej.
W 1986 r. Christe przedstawił metodę chemiczną do przygotowania fluorku przez reakcję między k2Mnf6 i SBF5.
Może ci serwować: alkohol poliwinylowyFizyczne i chemiczne właściwości
Wygląd
Fluor to jasnożółty gaz. W stanie płynnym jest jasnożółty. Tymczasem ciało stałe może być nieprzezroczyste (alfa) lub przezroczyste (beta).
Liczba atomowa (z)
9.
Masa atomowa
18 998 u.
Temperatura topnienia
-219,67 ºC.
Punkt wrzenia
-188,11 ºC.
Gęstość
W temperaturze pokojowej: 1696 g/l.
W temperaturze topnienia (ciecz): 1505 g/ml.
Ciepło parowe
6,51 kJ/mol.
Pojemność kaloryczna trzonowa
31 J/(mol · k).
Ciśnienie pary
W temperaturze 58 K ma ciśnienie pary 986,92 ATM.
Przewodność cieplna
0,0277 W/(M · K)
Zakon magnetyczny
Diamagnetyczny
Zapach
Pikantny i penetrujący charakterystyczny zapach, wykrywalny nawet przy 20 ppb.
Liczby utleniania
-1, który odpowiada anionowi fluoru, F-.
Energia jonizacji
-Po pierwsze: 1.681 kJ/mol
-Drugi: 3.374 kJ/mol
-Po trzecie: 6.147 kJ/mol
Elektronialiczność
3.98 w skali Pauling.
Jest to element chemiczny o największej elektroony; Oznacza to, że ma wysokie powinowactwo do elektronów atomów, z którymi są one połączone. Z tego powodu atomy fluorowe wytwarzają duże momenty dipolowe w określonych obszarach cząsteczki.
Jego elektrooniczność ma również inny efekt: atomy powiązane z nim tracą tyle gęstości elektronicznej, że zaczynają nabierać dodatnie obciążenie; To jest dodatnia liczba utleniania. Im więcej atomów fluorowych w związku, atom centralny będzie miał bardziej dodatnią liczbę utleniania.
Na przykład w2 Tlen ma liczbę utleniania +2 (lub2+F2-); W UF6, Uran ma liczbę utleniania +6 (u6+F6-); To samo dotyczy siarki w SF6 (S6+F6-); I wreszcie jest AGF2, gdzie srebro ma nawet liczbę utleniania +2, niezwykłe.
Dlatego elementy udaje się uczestniczyć z ich najbardziej dodatnimi liczbami utleniania, gdy tworzą związki z fluorkiem.
Środek utleniający
Fluor jest najpotężniejszym pierwiastkiem utleniającym, więc żadna substancja nie jest w stanie jej utlenić; I z tego powodu nie ma on z natury wolnego.
Reaktywność
Fluorka jest w stanie połączyć ze wszystkimi innymi pierwiastkami, z wyjątkiem helu, neonu i argonu. Nie atakuje również słodkiej stali ani miedzi w normalnych temperaturach. Reaguj gwałtownie materiałami organicznymi, takimi jak guma, drewno i tkanina.
Fluor może reagować z szlachetnym ksenonem gazu, tworząc silny utlenian2. Reaguje również z wodorem z wytworzeniem halogenku, fluoru wodoru, HF. Z kolei fluor wodorowy rozpuszcza się w wodzie, aby wytworzyć słynny kwas fluorhorowy (Eat Glass).
Kwasowość kwasów hydrace, sklasyfikowana w rosnącej kolejności, wynosi:
Hf < HCl < HBr < HI
Kwas azotowy reaguje z fluorkiem z tworzeniem azotanu fluoru, FNO3. Tymczas2 i CLF3.
Struktura elektroniczna i konfiguracja

Cząsteczka dwuatomiczna
 Cząsteczka fluoru reprezentowana za pomocą modelu wypełnienia przestrzeni. Źródło: Gabriel Bolívar.
Cząsteczka fluoru reprezentowana za pomocą modelu wypełnienia przestrzeni. Źródło: Gabriel Bolívar. Atom fluoru w stanie podstawowym ma siedem elektronów Walencji, które znajdują się w orbitalach 2 i 2p zgodnie z konfiguracją elektroniczną:
[On] 2s2 2 p5
Walencja Teoria linków (TEV) stwierdza, że dwa atomy fluorowe, F, są kowalencyjnie powiązane, aby ukończyć okT w Walencji.
Dzieje się tak szybko, ponieważ ledwo brakuje elektronu, aby stać się izolektronicznym i szlachetnym neonowym gazem; A jego atomy są bardzo małe, z bardzo silnym skutecznym obciążeniem jądrowym, które z łatwością wymaga elektronów środowiska.
Cząsteczka f2 (Doskonały obraz), ma prosty kowalencyjny link, F-F. Pomimo jego stabilności w porównaniu z wolnymi atomami F, jest to wyjątkowo reaktywna cząsteczka; Homonuklearne, apolarne i chętne do elektronów. Dlatego fluor, jak F2, Jest to bardzo toksyczny i niebezpieczny gatunek.
Ponieważ f2 Jest apolarną, jego interakcje zależą od masy cząsteczkowej i londyńskich sił dyspersji. W pewnym momencie chmura elektroniczna wokół obu atomów F musi odkształcić i poczynić się natychmiastowego dipola, który indukuje inny w sąsiedniej cząsteczce; aby były powoli i słabe.
Płynny i stały
Cząsteczka f2 Jest bardzo mały i rozprzestrzenia się w przestrzeni ze względną prędkością. W swojej fazie gazowej wykazuje jasnożółty kolor (który można mylić z limonką zieloną). Gdy temperatura spadnie do -188 ° C, siły dyspersji stają się bardziej skuteczne i sprawiają, że cząsteczki F2 Kohezja wystarczająca do zdefiniowania cieczy.
Ciekła fluor (pierwszy obraz) wygląda jeszcze bardziej żółty niż odpowiedni gaz. W nim cząsteczki f2 Są bliżej i w większym stopniu oddziałują ze światłem. Co ciekawe, po utworzeniu zniekształconego szkła sześciennego z fluoru do -220 °.
Może ci służyć: rozgałęzione alkanyTeraz, gdy cząsteczki M2 Są tak blisko (ale bez ich rotacji molekularnych), wydaje się, że ich elektrony zyskują pewną stabilność, a zatem ich skok elektroniczny jest zbyt duży, aby światło mogło nawet wchodzić w interakcje ze szkłem.
Fazy krystaliczne
Ten kryształ sześcienny odpowiada fazie β (nie jest to alotropowe, ponieważ pozostaje taki sam F2). Gdy temperatura spada jeszcze bardziej, do -228 ° C, fluor stałej cierpi przejście fazowe; Szkło sześcienne przekształca się w monokliniczną, fazę α:
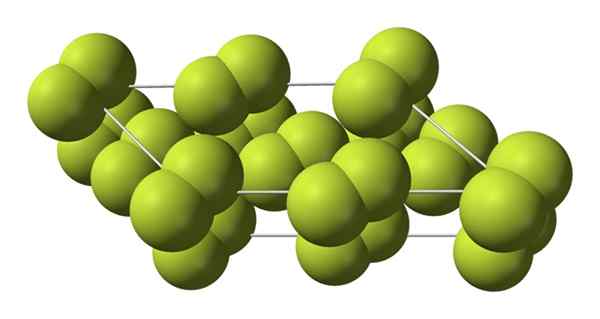
 Krystaliczna struktura fazy alfa fluoru. Źródło: Benjah-BMM27 [domena publiczna].
Krystaliczna struktura fazy alfa fluoru. Źródło: Benjah-BMM27 [domena publiczna]. W przeciwieństwie do β-f2, Α-f2 jest nieprzejrzyste i trudne. Może dzieje się tak, ponieważ cząsteczki M2 Nie mają już takiej swobody obracania się w ustalonych pozycjach w kryształach monoklinicznych; gdzie w większym stopniu oddziałują na światło, ale bez wzbudzania ich elektronów (co powierzchownie wyjaśniałoby ich krycie).
Krystaliczna struktura α-F2 Trudno było zbadać za pomocą konwencjonalnych metod dyfrakcji X. Wynika to z faktu, że przejście z fazy β na α jest bardzo egzotermiczne; Tak więc kryształ praktycznie wykorzystany, jednocześnie oddziałując niewiele z promieniowaniem.
Spędzili około pięćdziesięciu lat przed niemiecką naukowcami (Florian Kraus i współpracownicy), całkowicie rozszyfrowali strukturę α-F2 z większą precyzją dzięki technikom dyfrakcji neutronów.
Gdzie to jest i uzyskaj
Fluor zajmuje 24 z najczęstszych pierwiastków we wszechświecie. Jednak na Ziemi jest w masie 13Vo pierwiastek o stężeniu 950 ppm w skorupie ziemskiej i stężenie 1,3 ppm w wodzie morskiej.
Gleby mają stężenie fluoru między 150 a 400 ppm, a na niektórych glebach stężenie może osiągnąć 1.000 ppm. W powietrzu atmosferycznym występuje w stężeniu 0,6 ppb; Ale zarejestrował się w niektórych miastach do 50 ppb.
Fluorowa jest uzyskiwana głównie z trzech minerałów: fluoryt lub fluorospar (kawa2), Fluoroapatita [ca5(PO4)3F] i kreols (na3Alf6).
Przetwarzanie fluorytów
Po zebraniu skał za pomocą minerału fluorytowego podlegają one pierwotnemu i wtórnemu kruszaniu. Z wtórnym zmiażdżeniem uzyskania bardzo małych fragmentów skały.
Następnie fragmenty skały są zabierane do młyna kulowego w celu zmniejszenia pyłu. Woda i odczynniki są dodawane w celu utworzenia pasty, która jest umieszczana w zbiorniku flotacyjnym. Wstrzyknięto go ciśnieniem do tworzenia pęcherzyków, a zatem fluoryt kończy się na powierzchni wodnej.
Krzemiany i węglany są osadem, podczas gdy fluoryt jest zbierany i prowadzi do suszących piekarników.
Po uzyskaniu fluorytu reakcja reakcji z kwasem siarkowym w celu wytworzenia fluoru wodoru:
CAF2 + H2południowy zachód4 => 2 hf +obudowa4
Elektroliza fluoru wodoru
Podczas produkcji fluorków przestrzegane są niektóre modyfikacje, z metodą zastosowaną przez Moissona w 1886 roku.
Wykonana jest elektroliza mieszaniny stopionego fluorku potasu i kwasu fluohydowego o promieniu molowym 1: 2,0 do 1: 2,2. Temperatura stopionej soli wynosi 70–130 ° C.
Katoda składa się ze stopu monet lub stalowego, a anod. Proces produkcji fluoru podczas elektrolizy można schematyzować w następujący sposób:
2HF => H2 + F2
Woda służy do chłodzenia komory elektrolizy, ale temperatura musi znajdować się powyżej temperatury topnienia elektrolitu, aby uniknąć zestalania. Wodór wytwarzany w elektrolizy jest zbierany w katodzie, podczas gdy fluorek w anodzie.
Izotopy
Fluor ma 18 izotopów, będąc 19F Jedyny stabilny izotop o 100% obfitości. On 18F ma pół -life 109,77 minut i jest radioaktywnym izotopem fluoru z największym półfinią. On 18F jest używany jako źródło pozytronowe.
Artykuł biologiczny
Nie wiadomo, że aktywność metaboliczna fluoru u ssaków lub górnych roślin. Jednak niektóre rośliny morskie i gąbki syntetyzują monofluroacetat, trujący związek, który wykorzystuje jako ochronę, aby uniknąć zniszczenia.
Ryzyko
Nadmierne zużycie fluoru wiąże się z fluorozą kości u dorosłych i fluorozy zębów u dzieci, a także z zmianami w funkcjonowaniu nerek. Z tego powodu Stany Zjednoczone (PHS) zasugerowało, że stężenie fluoru w wodzie pitnej nie powinno być większe niż 0,7 mg/l.
Tymczasem amerykańska Agencja Ochrony Enviromental (EPA) stwierdziła, że stężenie fluoru w wodzie pitnej nie powinno być większe niż 4 mg/l, aby uniknąć fluorozy szkieletowej, w której fluorek gromadzi się w kościach. Może to powodować osłabienie kości i złamania.
Fluorowa jest związana z uszkodzeniem gruczołu przytarczyc, ze spadkiem wapnia w strukturach kostnych i wysokim stężeniu wapnia w osoczu.
Może ci służyć: żywa materia: koncepcja, cechy i przykładyWśród zmian przypisanych nadmiarowi fluoru są: fluorozę zębów, fluoroza szkieletowa i uszkodzenie gruczołu paratydycznego.
Fluoroza zębów
Fluoroza zębów ma małe paski lub motocykle w szkliwie zębów. Dzieci poniżej 6 roku.
Fluoroza szkieletowa
W fluorozie szkieletowej można zdiagnozować ból i uszkodzenie uszkodzenia, a także w stawach. Kość może stwardnieć i stracić elastyczność, co zwiększa ryzyko złamań.
Aplikacje
Pasta do zębów
 Niektóre nieorganiczne sole fluorku są stosowane jako addekt w sformułowaniu past dentystycznych, które wykazały, że pomagają chronić szkodę dentystyczną. Źródło: Pxhere.
Niektóre nieorganiczne sole fluorku są stosowane jako addekt w sformułowaniu past dentystycznych, które wykazały, że pomagają chronić szkodę dentystyczną. Źródło: Pxhere. Zaczynamy od sekcji zastosowań fluorku z tym najbardziej znanym: służyć jako składnik wielu past dentystycznych. Nie jest to jedyne zastosowanie, w którym można zobaczyć kontrast między jej cząsteczką F2, niezwykle trujący i niebezpieczny, a anion f-, które w zależności od środowiska mogą być korzystne (choć czasem nie).
Kiedy jemy jedzenie, zwłaszcza słodycze, bakterie je degradują, zwiększając kwasowość naszej śliny. Następnie jest punkt, w którym pH wystarczy, aby zdegradować i zdemineralizować szkliwo dentystyczne; Hydroksyiapatyt ma „w dół”.
Jednak w tym procesie jony f- Współdziałać z CA2+ tworzyć matrycę fluorapatytową; bardziej stabilny i trwały niż hydroksyapatyt. A przynajmniej jest to proponowany mechanizm wyjaśniający działanie anionu fluoru na zęby. Jest prawdopodobne, że jest bardziej złożony i że istnieje hydroksyapatyt-fluorapatyt w zależności od pH.
Te aniony f- Są one dostępne w Papas dentystycznych w sole; takie jak: NAF, SNF2 (Słynny fluor stine) i Napof. Jednak stężenie F- Musi być niski (mniej niż 0,2%), ponieważ w przeciwnym razie powoduje negatywny wpływ na ciało.
Fluoryzacja wodna
Bardzo podobne do tego, jak z pastami dentystycznymi sole fluorkowe zostały dodane do źródeł wody pitnej w celu zwalczania wyglądu próchnicy u tych, którzy je piją. Stężenie musi być nadal znacznie niższe (0,7 ppm). Jednak ta praktyka jest zwykle nieufna i kontrowersja, ponieważ możliwe zostały przypisane efekty rakotwórcze.
Środek utleniający
Gas f2 Zachowuje się jak bardzo silny środek utleniający. To sprawia, że wiele związków układa się więcej niż narażona na tlen i źródło ciepła. Dlatego był używany w rakietowych mieszaninach paliwowych, w których mogą nawet zastąpić ozon.
Polimery
W wielu zastosowaniach wkład fluoru nie jest spowodowany f2 lub f-, ale bezpośrednio do jego atomów elektroungatywnych tworzących część związku organicznego. Dlatego w istocie linku C-F.
W zależności od struktury polimery lub włókna z wiązaniami C-F są zwykle hydrofobowe, więc nie są mokre ani nie odporają na atak kwasu fluorhorowego; Lub jeszcze lepiej, mogą być doskonałymi izolatorami elektrycznymi i przydatnymi materiałami, z którymi produkowane są obiekty takie jak rury i stawy. Teflon i Navion są przykładami tych fluorowanych polimerów.
Farmaceuci
Reaktywność fluoru nazywana jest jego zastosowaniem do syntezy wielu związków fluoryny, organicznych lub nieorganicznych. W organicznych, w szczególności tych z efektami farmakologicznymi, zastępuj jeden z ich heteroátomos atomem f (pozytywnie lub negatywnie) jego działaniem na ich obiektywę biologiczną.
Dlatego w branży farmaceutycznej modyfikacja niektórych leków jest zawsze na stole poprzez dodanie atomów fluorowych.
Bardzo podobne występuje z herbicydami i fungicydami. Fluor w nich może zwiększyć swoje działanie i skuteczność na owadach i szkodnikach grzybów.
Grawerowanie szkła
Kwas fluorowy, ze względu na agresywność szkła i ceramiki, zastosowano do rejestrowania cienkich i delikatnych kawałków tych materiałów; Zwykle przeznaczone do produkcji mikrokomponentów komputerów lub do żarówek elektrycznych.
Wzbogacenie uranu
Jednym z najbardziej odpowiednich zastosowań fluoru elementarnego jest pomóc wzbogacić uran jako 235LUB. Aby to zrobić, minerały uranu rozpuszczają się w kwasie fluorowym, wytwarzając UF4. Ten nieorganiczny fluorek reaguje następnie z F2, Aby przekształcić się w UF6 (235Ufw6 I 238Ufw6).
Później, a poprzez wirowanie gazu, 235Ufw6 Oddziela się od 238Ufw6 a następnie utleniane i przechowywane jako paliwo jądrowe.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Krämer Katrina. (2019). Struktura zamrożonego fluoru została skosztowana po 50 latach. Royal Society of Chemistry. Odzyskane z: ChemistryWorld.com
- Wikipedia. (2019). Fluor. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2019). Fluor. Baza danych Pubchem. CID = 24524. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Dr. Doug Stewart. (2019). Fakty elementów fluorowych. Chemicool. Odzyskane z: Chemicool.com
- Batul Nafisa Baxamusa. (21 lutego 2018 r.). Zaskakująco powszechne zastosowania wysoce reaktywnej fluoru. Odzyskane z: Scienceruck.com
- Paola Opazo Sáez. (4 lutego 2019). Fluor w pasty do zębów: czy jest to dobre czy złe dla zdrowia? Odzyskany z: Nacionfarma.com
- Karl Christe i Stefan Schneider. (8 maja 2019 r.). Fluor: element chemiczny. Encyclopædia Britannica. Odzyskane z: Britannica.com
- Lentech b.V. (2019). Tabela okresu: tlen. Odzyskane z: lentech.com
- Gagnon Steve. (S.F.). Element fluorowy. Jefferson Lab. Odzyskane z: edukacja.Jlab.org
- American Cancer Society Medical and Editorial Content Team. (28 lipca 2015 r.). Fluoryzacja wodna i ryzyko raka. Odzyskane z: raka.org
- « Charakterystyka nauk ścisłych, co studiujesz, przykłady
- Brak historii metali, właściwości, grup, użycia »

