Struktura azotanu cynku, właściwości, uzyskiwanie, zastosowania

- 4177
- 94
- Matylda Duda
On azotan cynku Jest to związek nieorganiczny utworzony przez elementy cynku (Zn), azot (N) i tlen (O) (O). Status utleniania cynku wynosi +2, status azotu wynosi +5, a tlen wynosi -2.
Jego formuła chemiczna to Zn (nie3)2. Jest to stały bezbarwny krystaliczny, który ma tendencję do wchłaniania wody ze środowiska. Można go uzyskać przez leczenie metalu cynku rozcieńczonym kwasem azotowym. Jest to silnie utleniający związek.
 Azotan FIFR Zn (nie3)2. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons.
Azotan FIFR Zn (nie3)2. Domena Ondřej Mang / pub. Źródło: Wikimedia Commons. Służy jako akcelerator reakcji chemii organicznej i pozwala uzyskać złożone polimery o właściwościach napędowych energii elektrycznej. Służy do tworzenia warstw przydatnych materiałów w elektronice.
Jest częścią niektórych płynnych nawozów i niektórych herbicydów powolnych. Pomoc w przygotowaniu złożonych tlenków poprawiających gęstość i przewodność elektryczną.
Z powodzeniem przetestowano go w uzyskiwaniu struktur, które służą jako podstawa regeneracji i wzrostu tkanki kostnej, poprawiając ten proces i powodując przeciwbakteryjne.
Chociaż nie jest to paliwo, może przyspieszyć spalanie substancji, takich jak węgiel lub materiały organiczne. Jest to drażniąca skóra, oczy i błony śluzowe i jest bardzo toksyczne dla życia wodnego.
[TOC]
Struktura
Azotan cynku jest związkiem jonowym. Ma kation dwuwartościowy (Zn2+) i dwa monowalentne aniony (nie3-). Anion azotanu jest jonem poliatomicznym utworzonym przez atom azotu w stanie utleniania +5 przyłączonym do trzech atomów tlenu z walencją od -2.
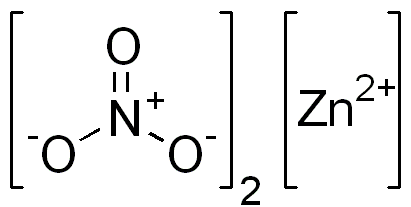 Jonowa struktura azotanu cynku. Domena EDGAR181 / PUB. Źródło: Wikimedia Commons.
Jonowa struktura azotanu cynku. Domena EDGAR181 / PUB. Źródło: Wikimedia Commons. Poniższy obraz pokazuje strukturę przestrzenną tego związku. Szara środkowa kula to cynk, niebieskie kule to azot, a czerwone kule reprezentują tlen.
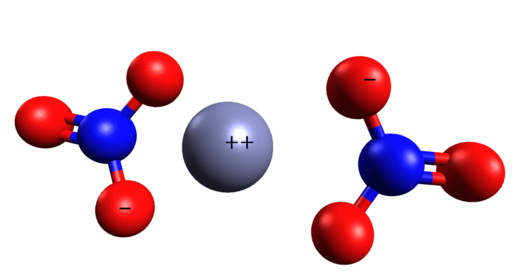 Struktura przestrzenna Zn (nie3)2. Cinc jest w środku jonów azotanowych. Grasso Luigi/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Struktura przestrzenna Zn (nie3)2. Cinc jest w środku jonów azotanowych. Grasso Luigi/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Nomenklatura
- Azotan cinc
- Dinitate cynku
Nieruchomości
Stan fizyczny
Bezbarwne stałe lub krystaliczne białe.
Waga molekularna
189,40 g/mol
Temperatura topnienia
Około 110 ° C.
Może ci służyć: kwas iarhydrryczny (HI): Struktura, właściwości i zastosowaniaPunkt wrzenia
Około 125 ° C.
Gęstość
2065 g/cm3
Rozpuszczalność
Rozpuszczalna w wodzie: 120 g/100 g h2Lub w 25 ° C. Alkohol rozpuszczalny.
Ph
Jego wodne roztwory są kwaśne. Roztwór 5% ma pH około 5.
Właściwości chemiczne
Ponieważ bycie azotanem ten związek jest silnym utleniaczem. Reaguje gwałtownie węglem, miedź, siarczki metali, materia organiczna, fosfor i siarka. Jeśli jest rozpylany na gorące wyczyny węglowe.
Z drugiej strony jest higroskopijny i pochłania wodę ze środowiska. Jeśli tlenek cynku powstaje, azot i dwutlenek tlenu:
2 Zn (nie3)2 + ciepło → 2 ZnO + 4 NO2↑ + o2↑
W roztworach alkalicznych, takich jak NaOH, cynk tego związku tworzy jego wodorotlenek i inne złożone gatunki:
Zn (nie3)2 + 2 Och- → Zn (OH)2 + 2 nie3-
Zn (OH)2 + 2 Och- → [Zn (OH)4]2-
Uzyskanie
Można go uzyskać przez leczenie cynku lub tlenku cynku rozcieńczonym kwasem azotowym. W tej reakcji powstaje gaz wodorowy.
Zn + 2 Hno3 → Zn (nie3)2 + H2↑
Aplikacje
Kataliza reakcji
Jest stosowany jako katalizator w uzyskiwaniu innych związków chemicznych, takich jak żywice i polimery. Jest to kwasowy katalizator.
 Przykład żywicy. Bugman w angielskiej Wikipedii / domenie publicznej. Źródło: Wikimedia Commons.
Przykład żywicy. Bugman w angielskiej Wikipedii / domenie publicznej. Źródło: Wikimedia Commons.  Model struktury polimeru. Domena Ilmari Karonen / Pub. Źródło: Wikimedia Commons.
Model struktury polimeru. Domena Ilmari Karonen / Pub. Źródło: Wikimedia Commons. Innym przypadkiem przyspieszenia reakcji jest katalityczny układ Zn (NO3)2/VOC2ALBO4, co umożliwia utlenianie α-hydrolyster.
W złożonych polimerach
Opracowano filmy polimetylogetacrylanu i Zn (nie3)2 z właściwościami przewodnictwa elektrycznego, które czynią ich odpowiednimi kandydatami do stosowania w superkagenach i komputerach o wysokiej prędkości.
W cementach oksyystowych
Z wodnymi roztworami azotanu cynku i proszkiem tlenku cynku uzyskuje się materiały należące do klasy cementów wytwarzanych przez reakcję kwasowo-zasadową.
Mają one rozsądną odporność na rozpuszczenie w rozcieńczonych kwasach i alkaliach, rozwijając kompresję odporności na kompresję w porównaniu z innym cementem.
Ta właściwość wzrasta, gdy wskaźnik ZnO/Zn jest zwiększony (nie3)2, A gdy stężenie Zn jest przesyłane (nie3)2 W rozwiązaniu. Otrzymane cementy są całkowicie amorficzne, to znaczy nie mają kryształów.
Może ci służyć: opady chemiczne Z azotanem cynku przeprowadzono testy na uzyskanie cementów. Autor: Kobthanapong. Źródło: Pixabay.
Z azotanem cynku przeprowadzono testy na uzyskanie cementów. Autor: Kobthanapong. Źródło: Pixabay. W powłokach i nanomateriałach tlenku cynku
Zn (nie3)2 Służy do osadzania elektrolitycznego bardzo cienkich warstw tlenku cynku (ZnO) na różnych podłożach. Na powierzchniach przygotowywane są również nanostruktury tego tlenku.
 Nanocząstki tlenku cynku. Niektóre nanostruktury ZnO można przygotować za pomocą Zn (nie3)2. Verena Wilhelmi, Ute Fischer, Heike Waighardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC przez (https: // creativeCommons.Org/licencje/według/2.5). Źródło: Wikimedia Commons.
Nanocząstki tlenku cynku. Niektóre nanostruktury ZnO można przygotować za pomocą Zn (nie3)2. Verena Wilhelmi, Ute Fischer, Heike Waighardt, Klaus Schulze-Osthoff, Carmen Nickel, Burkhard Stahlmecke, Thomas A. J. Kuhlbusch, Agnes M. Scherbart, Charlotte Esser, Roel P. F. Schins, Catrin Albrecht/CC przez (https: // creativeCommons.Org/licencje/według/2.5). Źródło: Wikimedia Commons. ZnO jest materiałem bardzo interesującym ze względu na wiele zastosowań w dziedzinie optolektroniki, ma również właściwości półprzewodników i jest stosowany w czujnikach i przetwornikach.
W herbicydach
Azotan CINC był używany razem z niektórymi związkami organicznymi, aby zmniejszyć prędkość uwalniania niektórych herbicydów w wodzie. Powolne uwalnianie tych produktów pozwala im być dostępne na dłużej i wymagane jest mniej aplikacji.
W produkcji Anod
Stymuluje proces spiekania i poprawia gęstość niektórych tlenków, które służą do wytwarzania anod dla ogniw paliwowych. Spiekanie uzyskuje stały materiał przez ogrzewanie i kompresję proszku bez osiągnięcia połączenia.
 Rysowanie, w jaki sposób występuje spiekanie dwóch ziaren. Zn (nie3)2 Pomoc w wykonywaniu tego procesu na niektórych złożonych tlenkach. Domena CDang / Pub. Źródło: Wikimedia Commons.
Rysowanie, w jaki sposób występuje spiekanie dwóch ziaren. Zn (nie3)2 Pomoc w wykonywaniu tego procesu na niektórych złożonych tlenkach. Domena CDang / Pub. Źródło: Wikimedia Commons. Materiały, w których przeprowadzono testy, to złożone tlenki strontu, irydium, żelaza i tytanu. Obecność FAL znacznie zwiększa przewodność elektryczną.
Inne aplikacje
Jest stosowany w uzyskiwaniu leków. Działa jako mordant w stosowaniu atramentów i barwników. Służy jako koagulant lateksowy. Jest źródłem cynku i azotu w nawozach ciekłych.
Potencjalne zastosowanie w inżynierii tkanek kostnych
Związek ten został wykorzystany jako dodatek do opracowania pancerza lub ramek do regeneracji włókien kostnych, ponieważ pozwala poprawić oporność mechaniczną tych struktur.
Może ci służyć: Germanio: Historia, właściwości, struktura, pozyskiwanie, użyciaZaobserwowano, że rusztowanie zawierające fifia nie jest toksyczne dla komórek osteoprogenitorowych, potwierdza aktywność osteoblastów, które są komórkami wytwarzającymi kości i poprawiają ich adhezję i proliferację.
Sprzyja tworzeniu się apatity, które jest minerałem, który tworzy kości, a także wywiera działanie przeciwbakteryjne.
 Zn (nie3)2 Może to być bardzo przydatne do odbudowy materii kości u ludzi, którzy doznali wypadków. Mariano Coretti/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons.
Zn (nie3)2 Może to być bardzo przydatne do odbudowy materii kości u ludzi, którzy doznali wypadków. Mariano Coretti/cc by-SA (https: // creativeCommons.Org/licencje/nabrzeże/4.0). Źródło: Wikimedia Commons. Ryzyko
Jest to materiał o potencjalnym ryzyku pożaru i eksplozji.
To nie jest paliwo, ale przyspiesza spalanie materiałów palnych. Jeśli duża ilość tego związku jest zaangażowana w pożar lub jeśli materiał palny jest drobno podzielony, może wystąpić wybuch.
Po poddaniu silnego ciepła wytwarzane są toksyczne tlenki azotu. A jeśli ekspozycja jest przeprowadzana, może eksplodować.
Jest to drażniące dla skóry, może powodować poważne uszkodzenie oczu, podrażnienie w dróg oddechowych, jest toksyczne z powodu spożycia i powoduje uszkodzenie przewodu pokarmowego.
Bardzo toksyczny dla życia wodnego z efektami, które ostatnie.
Bibliografia
- Ju i. i in. (2019). Nowy wpływ azotanu cynku/wanadylu szczawianu do selektywnego katalitycznego utleniania estrów alfa-hydroksy na alfa-keto z tlenem cząsteczkowym: in situ. Cząsteczki 2019, 24, 1281. MDPI odzyskało.com.
- Mohd s., S.N. i in. (2020). Kontrolowane uwalniane preparat azotanu wodorotlenku cynku interkalowane z dodecylosulpe sodu i anionów Bispyrybac: Nanokompozyt herbicydowy do uprawy prawnej. Arabian Journal of Chemistry 13, 4513-4527 (2020). Odzyskane z naukowym.
- Man, m.P. i in. (2019). Wzbogacona wytrzymałość mechaniczna i mineralizacja kości elektrospun biomimetyczne rusztowanie obciążone olejem Ylang Ylang i azotan cynku do inżynierii tkanki kostnej. Polymers 2019, 11, 1323. MDPI odzyskało.com.
- Kim, k.Siema. i in. (2018). Wpływ azotanu cynku jako pomocy spiekania na charakterystykę elektochemiczną SR0,92I0,08Wujek3-Delta i panie0,92I0,08Ty0,6Wiara0,4ALBO3-Delta Ceramics International, 44 (4): 4262-4270 (2018). Odzyskane z naukowym.com.
- Prasad, ur.I. i in. (2012). Elektrodepowanie powłoki ZnO z wodnego Zn (nie3)2 Łaźnie: Wpływ stężenia Zn, osadzania temperatury i czasu na orientację. J Solid State Electochem 16, 3715-3722 (2012). Link odzyskał.Skoczek.com.
- Bahadur, godz. i Srivastava, do.K. (2007). Morfologie cienkich warstw ZnO z sol-żel. Nanoscale Res Lett (2007) 2: 469-475. Link odzyskał.Skoczek.com.
- Nicholson, J.W. i Tibaldi, J.P. (1992). Tworzenie i właściwości cementu przygotowane z tlenku cynku i roztworów wodnych azotanu cynku. J Mater Sci 27, 2420-2422 (1992). Link odzyskał.Skoczek.com.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- Maji, s. i in. (2015). Wpływ Zn (nie3)2 Wypełniacz Dielecric Demility and Electrical Moduus PMMA. Bull Mater Sci 38, 417-424 (2015). Link odzyskał.Skoczek.com.
- LUB.S. National Library of Medicine. (2019). Azotan cynku. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Byju's. (2020). Azotan cynku - Zn (NO3) 2. Odzyskane z Byjusa.com.
- Elementy amerykańskie. Azotan cynku. Odzyskane z amerykańskich.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- « Struktura chlorku cynku (ZNCL2), właściwości, uzyskiwanie, zastosowania
- Konkretne przypadki postępowania etycznego w instytucjach i organizacjach »

