Struktura chlorku cynku (ZNCL2), właściwości, uzyskiwanie, zastosowania

- 2811
- 677
- Arkady Sawicki
On chlorek cynku Jest to związek nieorganiczny utworzony przez element cynku lub cynku (Zn) i chlor (CL). Jego formuła chemiczna to ZnCl2. CINC znajduje się w stanie utleniania +2, a chlor ma walencję -1.
Jest to bezbarwna lub biała krystaliczna stała. Jest bardzo rozpuszczalny w wodzie i łatwo wchłania ją ze środowiska, co można zobaczyć na postaci zwilżonej substancji stałej pokazanej poniżej.
 Chlorek FIFCL2 Solidny nieco nawodniony. Użytkownik: Walkerma / Public Domena. Źródło: Wikimedia Commons.
Chlorek FIFCL2 Solidny nieco nawodniony. Użytkownik: Walkerma / Public Domena. Źródło: Wikimedia Commons. Cynk tego związku jest biologicznie bardzo ważny dla ludzi, zwierząt i roślin, ponieważ interweniuje w podstawowych funkcjach, takich jak synteza białka i tłuszczu.
Z tego powodu ZNCL2 Jest stosowany jako uzupełnienie odżywcze dla zwierząt i ludzi w przypadkach niedoboru cynku oraz jako mikroelement dla roślin.
Ma właściwości bakteriostatyczne i ściągające i jest szeroko stosowany do tych celów zarówno w medycynie ludzkiej, jak i weterynaryjnej. Eliminuje także szkodniki, takie jak grzyby na świeżym powietrzu i są pośrednie w celu uzyskania pestycydów.
Wśród wielu zastosowań służy do leczenia włókien celulozy i wełny w różnych procesach, a także przygotowania ich do koloru lub drukowania. Opóźnij również spalanie drewna.
[TOC]
Struktura
Zncl2 Jest to związek jonowy utworzony przez kation Zn2+ i dwa aniony chlorkowe Cl- które wiążą się przez siły elektrostatyczne.
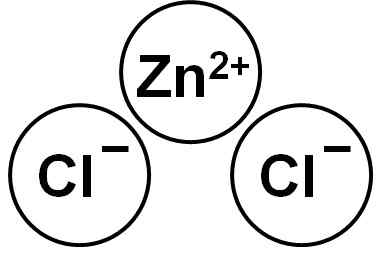 Chlorek cynku. Autor: Marilú Stea.
Chlorek cynku. Autor: Marilú Stea. Jon cynku (II) ma następującą strukturę elektroniczną:
1s2, 2s2 2 p6, 3s2 3p6 3d10, 4s0,
w którym obserwuje się, że oba elektrony Przylądka 4s, co konfiguracja jest stabilna.
Jon chlorkowy przedstawia następującą strukturę:
1s2, 2s2, 2 p6, 3s2 3p6,
który jest również bardzo stabilny do posiadania kompletnych orbitali.
Na rysunku można zaobserwować sposób, w jaki jony są dostępne w szkle. Szare kule reprezentują cynk i zielone kule do chloru.
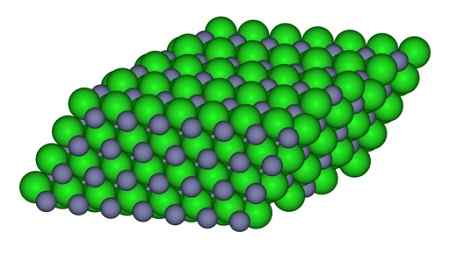 Struktura, która tworzy jony w krysztale ZnCl2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Struktura, która tworzy jony w krysztale ZnCl2. CCOIL/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. Nomenklatura
- Chlorek cynku (ii)
- Dichlorek cynku
Nieruchomości
Stan fizyczny
Bezbarwne stałe lub krystaliczne białe. Sześciokątne kryształy.
Waga molekularna
136,3 g/mol
Temperatura topnienia
290 ° C
Punkt wrzenia
732 ºC
Gęstość
2907 g/cm3 w 25 ° C
Rozpuszczalność
Bardzo rozpuszczalny w wodzie: 432 g/100 g h2Lub w 25 ° C, 614 g/100 g h2Lub 100 ° C. Bardzo rozpuszczalny w kwasie solnym (HCL), alkoholu i glicerolu. Całkowicie mieszane.
Może ci służyć: wodorotlenek rtęci: struktura, właściwości, zastosowania, ryzykoPh
Jego wodne roztwory są kwaśne. Roztwór 6 moli ZnCl2/L ma pH 1,0.
Właściwości chemiczne
Jest to związek higroskopijny i przysmakowy, ponieważ w kontakcie z wilgocią środowiska pochłania dużo wody. W wodzie jest hydrolizowany i ma tendencję do tworzenia podstawowego nierozpuszczalnego nierozpuszczalnego oksychlorku cynku.
Reaguje z tlenkiem cynku (ZnO) w wodzie wytwarzającej oksychlorki cynku, które stanowią niezwykle twardy materiał cementowy.
Jest delikatnie żrący w stosunku do metali.
To nie jest łatwopalne.
Rola biologiczna
Biologicznie cynk jest jednym z najważniejszych elementów. Został uznany za niezbędny na wszystkie sposoby życia.
W ludzkim ciele Zncl2 Zn zapewnia, co jest niezbędne dla białka, cholesterolu i syntezy tłuszczu. Szczególnie CINC jest ważne dla prawidłowego funkcjonowania układu odpornościowego.
 Zncl cynku2 Ważne jest dla podziału komórek w żywych istotach. Ladyofhats / domena publiczna. Źródło: Wikimedia Commons.
Zncl cynku2 Ważne jest dla podziału komórek w żywych istotach. Ladyofhats / domena publiczna. Źródło: Wikimedia Commons. Zidentyfikowano ponad 25 białek zawierających cynk, a wiele z nich to enzymy, niezbędne w podziale komórek i wzrostu oraz do uwalniania witaminy A z wątroby.
Niedobór CINC może prowadzić do wzrostu wzrostu, przygnębionej funkcji psychicznej, anoreksji, zapalenia skóry, zmniejszenia odporności, biegunki i złego widzenia nocnego, między innymi, między innymi.
Uzyskanie
W handlu ten związek jest wytwarzany przez reakcję wodnego kwasu solnego ze złomem, odpadami cynkowymi lub z zawierającym go minerałem. W tej reakcji występuje również wodór gazowy (h2).
Uzyskuje się obróbkę cynku chlorkiem wodoru w 700 ° C.
Zn + HCl → ZnCl2 + H2↑
Aplikacje
W zabiegach terapeutycznych
Jest to miękka lub bakteriostatyczna przeciwbakteryjna, więc jest stosowana w prysznice pochwy w celu wyeliminowania infekcji tricomonas lub hemofilus. Służy również do leczenia modzeli, jako ściągającego i chemioocirugii w raku skóry.
Jest używany jako ściągający w niektórych kosmetykach, takich jak orzeźwiające balsamy dla skóry.
Jako suplement diety
Ze względu na jego znaczenie w różnych funkcjach ludzkiego organizmu ZNCL2 Jest podawany doustnie w ramach akcesoriów żywieniowych, a także u osób wymagających żywności pozajelitowej.
Suplementy ZnCl2 Są dostarczane do strefy leczenia.
Może ci służyć: jednorodna mieszanka Suplementy ZnCl2 Powinny być używane, gdy występuje niedobór cynku. Autor: Moakets. Źródło: Pixabay.
Suplementy ZnCl2 Powinny być używane, gdy występuje niedobór cynku. Autor: Moakets. Źródło: Pixabay. Zdrowe osoby nabywają to przez jedzenie.
Powinien być dostarczany co najmniej 1 godzinę przed posiłkami lub 2 godziny po nich, ponieważ niektóre pokarmy mogą zapobiec ich wchłanianiu. U pacjentów z podrażnieniem żołądka po spożyciu suplementu powinien spożywać go z posiłkami, ale w ten sposób cynk będzie mniej biodispsononononon.
W aplikacjach weterynaryjnych
Jego roztwory były stosowane u zwierząt jako środek żrący do spalania lub przetoki kaulbody, które są połączeniami między narządami, które nie są normalne ani zdrowe; W postaci makaronu służy do leczenia wrzodów i chemioterapii raka.
 Wodne roztwory ZnCl2 Są stosowane w leczeniu infekcji oczu zwierząt. Autor: Mabel Amber. Źródło: Pixabay.
Wodne roztwory ZnCl2 Są stosowane w leczeniu infekcji oczu zwierząt. Autor: Mabel Amber. Źródło: Pixabay. W zakażeniach oczu bardzo rozcieńczony roztwór tego związku działa jako antyseptyczny i ściągający.
Jest również stosowany jako ślady w pary dla zwierząt lub jako suplement pokarmowy.
W specjalnych cementach
Reakcja między ZnCl2 A ZnO w wodzie wytwarza trochę oksychlorku cynku, który tworzą niezwykle twardy lub cementowy materiał. Głównymi składnikami są 4zno • Zncl2• 5H2O i ZnO • Zncl2• 2H2ALBO.
Ten rodzaj cementów opiera się na ataku kwasu lub wrzącej wody. Jednak pentahydrat jest bardzo stabilny i nierozpuszczalny, ale niezmienny, a dihydrat jest bardziej rozpuszczalny i może powodować odpływ płynny.
Z tych powodów cementu te mają niewiele aplikacji.
Jako katalizator
Służy do przyspieszenia niektórych reakcji chemii organicznej. Działa jako agent kondensacyjny. Na przykład w reakcjach aldolicznych reakcje aminacji i reakcje dodawania cyklu. W niektórych z tych działań jako radykalny inicjator.
Jest to kwas Lewisa i katalizuje reakcje Dielsa-Aldera. Jest również stosowany jako katalizator w reakcjach Friedel-Crafts, do produkcji barwników i barwników oraz w produkcji żywic poliesto-politycznych.
Poniżej znajduje się reakcja, w której ten związek interweniuje:
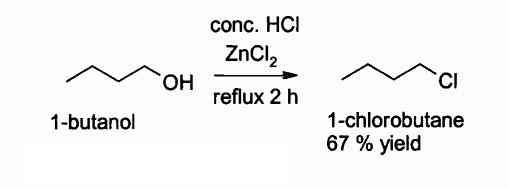 Reakcja uzyskania chlorku alkilu za pomocą ZNCL2. Autor: Walkerma. Źródło: Wikimedia Commons.
Reakcja uzyskania chlorku alkilu za pomocą ZNCL2. Autor: Walkerma. Źródło: Wikimedia Commons. W działaniach rolniczych
Został wykorzystywany jako herbicyd w uprawach, jako leczenie dolistne, w celu wyeliminowania szkodników, takich jak grzyby i mchu, a także jako mikroelement. Przygotowanie pestycydów jest pośrednikiem.
W zastosowaniach dentystycznych
Jest stosowany w myjkach jamy ustnej, jednak zalecany czas kontaktu jest bardzo krótki, więc działa tylko jako ściągający w błonie śluzowej jamy ustnej. Służy jako desensitizer, jest używany w pastach zębowych i jest częścią cementów dentystycznych.
Może ci służyć: chloryn sodu (NaClo2): struktura, właściwości, zastosowania, ryzykoW branży tekstylnej i papierowej
Jest składnikiem rozpuszczalnika stosowanego w produkcji Rayona lub sztucznego jedwabiu z celulozy. Jest to agent siatkowy lub związek związkowy dla żywic kończących się na tekstyliach. Służy również do leczenia ich i faworyzowania ich ochrony.
Pozwala na zwijanie tkanin, oddzielenia włókien jedwabnych i wełnianych i działa jak mordant w drukowaniu i zabarwieniu tekstyliów.
Jest używany do produkcji zwojów papieru i do produkcji papieru naleśnika.
W przygotowaniu nanocząstek
Reagując na chlorek cynku z siarczkiem sodu (na2S) poprzez metodę sonochemiczną i w obecności niektórych związków organicznych Nanocząstki siarczku cynkowego (Zns). Metody sonochemiczne wykorzystują fale dźwiękowe, aby powodować reakcje chemiczne.
Ten typ nanomateriałów może mieć zastosowanie jako środki fotokatalityczne do wytworzenia, na przykład, podział wody w jej składnikach (wodór i tlen) przez działanie światła.
W kilku aplikacjach
- Dezodorant, antyseptyczny i dezynfekujący obszarów. Kontrola mchu, pleśni i grzybów w sąsiednich strukturach i obszarach, takich jak chodniki, dziedzińce i ogrodzenia. Środki dezynfekujące toalety, mocz, dywany i drewno sprężone.
- Stosowane w mieszankach do zarażenia i roztworów do zachowania próbek anatomicznych.
- Drewniany opóźniony płomień.
- Podstawowy składnik pomp dymowych używanych do rozproszenia wielu ludzi; Strażacy używają ich w ćwiczeniach i ćwiczeniach przeciwpożarowych.
 Chlorek Cinc jest używany w pompach dymowych używanych w ćwiczeniach wojskowych. LUB.S. Departament Obrony obecny fotoscpl. Abraham Lopez / 2. Dywizja Morska / domena publiczna. Źródło: Wikimedia Commons.
Chlorek Cinc jest używany w pompach dymowych używanych w ćwiczeniach wojskowych. LUB.S. Departament Obrony obecny fotoscpl. Abraham Lopez / 2. Dywizja Morska / domena publiczna. Źródło: Wikimedia Commons. - Komponent przepływu spawania. W nagrywanie metalowym. Do kolorowania stalowego komponent łazienki ocynkowanej i żelaza z miedzi.
- W cementach magnezu i cementu metalu.
- Łamać emulsje w rafinacji oleju. Agent w produkcji asfaltowej.
- Elektrolit w suszonych bateriach.
 Sucha bateria ZnCl2. Użytkownik: 32bitmaschine; Edytowane przez użytkownika Jaybear/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons.
Sucha bateria ZnCl2. Użytkownik: 32bitmaschine; Edytowane przez użytkownika Jaybear/CC BY-S (https: // creativeCommons.Org/licencje/by-sa/3.0). Źródło: Wikimedia Commons. - Wulkanizacja gumy.
- Środek odwodniowy.
Ryzyko
Może powodować oparzenia oczu, skórze i błonach śluzowych.
Po podgrzaniu do jego rozkładu emituje toksyczny chlorek wodoru (HCl) i tlenku cynku (ZnO).
Ostrzeżenie o jego zastosowaniu jako narkotyku
Chociaż brakuje rozstrzygających badań, szacuje się, że jeśli ten związek jest podawany kobietom w ciąży, może to spowodować uszkodzenie płodu. Ale potencjalne korzyści mogą mieć większą wagę niż możliwe ryzyko.
Bibliografia
- LUB.S. National Library of Medicine. (2019). Cynk chlorkowy. Odzyskane z Pubchem.NCBI.NLM.Nih.Gov.
- Liska, m. i in. (2019). Specjalny cement. Cement oksychlorku cynku. W Chemii Cementu i Betonu Lea (wydanie piąte). Odzyskane z naukowym.
- Pohanish, r.P. (2017). Cynk chlorkowy. W podręczniku Sittig z toksycznych i niebezpiecznych chemikaliów i raków (wydanie siódme). Odzyskane z naukowym.com.
- Gedanken, a. i Perelshtein, ja. (2015). Ultradźwięki mocy do produkcji nanomateriałów. W mocy ultrasoniki. Odzyskane z naukowym.
- Archibald, s.J. (2003). Grupy metalowe przejściowe 9-12. Reakcje i kataliza. W zrozumieniu chemii koordynacji II. Odzyskane z naukowym.com.
- Bawełna, f. Albert i Wilkinson, Geoffrey. (1980). Zaawansowana chemia nieorganiczna. Czwarta edycja. John Wiley & Sons.
- Ołów, d.R. (redaktor) (2003). Podręcznik chemii i fizyki CRC. 85th CRC Press.
- « Struktura chromianu cynku, właściwości, uzyskiwanie, zastosowania
- Struktura azotanu cynku, właściwości, uzyskiwanie, zastosowania »

