Struktura azotanu srebra (AGNO3), właściwości, zastosowania, toksyczność

- 4933
- 905
- Pani Gilbert Stolarczyk
On azotan srebra Jest to sól nieorganiczna, której mieszanką chemiczną jest Agno3. Spośród wszystkich soli srebra jest to najbardziej ekonomiczna i ta, która przedstawia względną stabilność przeciwko światłem słonecznym, więc mniej się rozkłada. Jest to rozpuszczalne i przedwczesne źródło srebra w każdym laboratorium nauczania lub badawczym.
W nauczaniu roztwory wodne azotanu srebra są używane do nauczania reakcji wytrącania chlorku srebra. Podobnie, roztwory te są w kontakcie z metalową miedzią, aby zająć reakcję Rédox, w której srebro metalu wytrąca się pośrodku uformowanego rozpuszczania azotanu miedzi, Cu (no3)2.
 Pojemnik na próbki azotanu srebra. Źródło: w. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
Pojemnik na próbki azotanu srebra. Źródło: w. Oelen/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Na górnym obrazie pokazano butelkę z azotanem srebrnym. Można go wystawiać na światło bez wkrótce ciemnienia kryształów, produktu wyglądu tlenku srebra.
Zgodnie z alchemicznymi zwyczajami i właściwościami przeciwbakteryjnymi srebra metalu, azotan srebra zastosowano do dezynfekcji i kauteryzacji ran. Jednak w tym celu stosuje się bardzo rozcieńczone roztwory wodne lub jego stałe zmieszane z azotanem potasu przyłożone przez czubek drewnianych prętów.
[TOC]
Struktura azotanu srebra
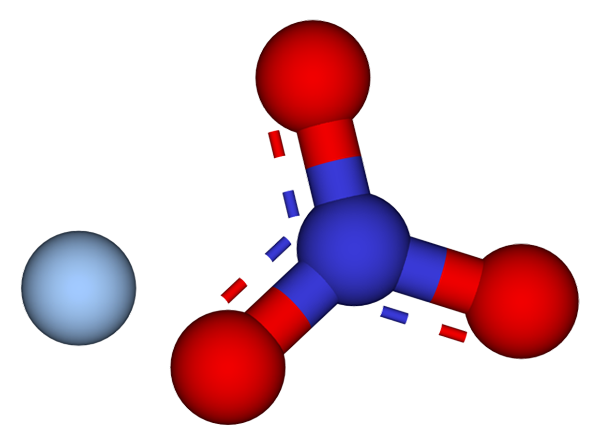 Jony, które składają się na kryształy azotanu srebra. Źródło: CCOIL/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0)
Jony, które składają się na kryształy azotanu srebra. Źródło: CCOIL/CC BY-SA (https: // creativeCommons.Org/licencje/by-sa/3.0) Na górnym obrazie jony Ag są pokazane+ i nie3- azotanu srebra, które są reprezentowane przez model sfer i prętów. Formuła Agno3 Wskazuje stechiometryczną proporcję tej soli: dla każdego kationu AG+ Nie ma anion3- interakcja z nim elektrostatycznie.
Może ci służyć: siarka: historia, właściwości, struktura, uzyskiwanie, użyciaAnion nr3- (czerwonych i niebieskawowych kul) ma trygonalną płaską geometrię, z obciążeniem ujemnym demokującym między trzema atomami tlenu. Dlatego oddziaływania elektrostatyczne między dwoma jonami zachodzą konkretnie między kationem+ a atom tlenu anionu nie3- (Ag+-ALBO NIE2-).
W ten sposób każdy ag+ kończy się koordynacją lub otaczającymi trzy nie3- sąsiadujący w tej samej płaszczyźnie lub warstwie krystalograficznej. Grupowanie tych samolotów ostatecznie definiuje kryształ, którego struktura jest ortorombowa.
Przygotowanie
Azotan srebra przygotowuje się przez atakowanie wyściełanego metalowego srebrnego kawałka kwasem azotowym, zarówno zimnym, jak i gorącym skoncentrowanym:
3 ag + 4 hno3 (rozcieńczone) → 3 Agno3 + 2 godz2O +no
AG + 2 HNO3 (skoncentrowane) → Agno3 + H2O +no2
Zwróć uwagę na tworzenie gazów nie, a nie2, które są toksyczne i zmuszają tę reakcję, aby nie być przeprowadzane poza dzwonkiem ekstraktora.
Fizyczne i chemiczne właściwości
Wygląd fizyczny
Bezbarwne krystaliczne stałe, toaleta, ale bardzo gorzki smak.
Masa cząsteczkowa
169 872 g/mol
Temperatura topnienia
209,7 ºC
Punkt wrzenia
440 ° C. Jednak w tej temperaturze cierpi na rozkład termiczny, w którym występuje srebro metalu:
2 Agno3(L) → 2 Ag (s) + o2 (g) + 2 nie2 (G)
Nie ma oparów Agno3, Przynajmniej nie w warunkach naziemnych.
Rozpuszczalność
Agno3 Jest to niezwykle rozpuszczalna oszczędność wody, która ma rozpuszczalność 256 g/ 100 ml w 25 ° C. Jest również rozpuszczalny w innych rozpuszczalnikach polarnych, takich jak amoniak, kwas octowy, aceton, eter i glicerol.
Gęstość
4,35 g/cm3 w 24 ° C (temperatura otoczenia)
Może ci służyć: woda destylowana3,97 g/cm3 w 210 ° C (tylko w punkcie topnienia)
Stabilność
Agno3 Jest to substancja stabilna, gdy jest odpowiednio przechowywana. Nie stanie się zapalenie w żadnej temperaturze, chociaż można go rozbić poprzez zwolnienie tlenków azotu toksyczne opary.
Z drugiej strony, chociaż azotan srebra nie jest łatwopalny, jest to silny środek utleniający, który w kontakcie z materią organiczną i źródłem ciepła jest w stanie wywołać egzotermiczną i wybuchową reakcję reakcji.
Oprócz tego sól nie powinna być narażona zbyt dużo czasu na światło słoneczne, ponieważ ich kryształy są przyciemnione z powodu tworzenia tlenku srebra.
Zastosowanie azotanu srebra
Środek wytrących i analityczny
W poprzedniej sekcji wzmiankę o niesamowitej rozpuszczalności Agno została dokonana3 W wodzie. To oznacza, że jony ag+ Rozpuszczają się bez żadnego problemu i będą dostępne do interakcji z dowolnym jonem wodnym, takim jak aniony halogenkowe (x = f-, Cl-, Br- i ja-).
Srebro jak ag+, I po dodaniu HNO3 Rozcieńczone, wytrąca się fluorki, chlorki, bromki i joddy, które składają się z białych lub żółtawych ciał stałych:
Ag+(AC) +x-(AC) → AGX (S)
Ta technika jest bardzo nawracająca w celu uzyskania halogenomoru i jest również stosowana w wielu ilościowych metodach analitycznych.
Odczynnik Tollens
Agno3 Odgrywa również rolę analityczną w chemii organicznej, ponieważ jest głównym odczynnikiem, obok amoniaku, do przygotowania odczynnika Tollens. Odczynnik ten jest wykorzystywany w próbach jakościowych, które pozwalają na określenie obecności aldehydów i ketonów w próbce problemowej.
Synteza
Agno3 Jest to doskonałe rozpuszczalne źródło jonów srebra. To, oprócz jego względnego i niskiego kosztu, czyni go żądanym odczynnikiem dla niezliczonej syntezie organicznej i nieorganicznej.
Może ci służyć: Gibbs Free Energy: Jednostki, jak jest obliczane, rozwiązane ćwiczeniaNiezależnie od reakcji, jeśli potrzebujesz jonów Ag+, Jest więc całkiem prawdopodobne, że chemikalia uciekają się do Agno3.
Leczniczy
Agno3 Miał dużą popularność w medycynie przed pojawieniem się współczesnych antybiotyków. Dziś jednak jest nadal używany w określonych przypadkach, ponieważ ma właściwości Caulster i Antibacterial.
Zwykle jest mieszany z kno3 Na czubku drewnianych prętów, tak aby był zarezerwowany wyłącznie do zastosowań miejscowych. W tym sensie służył do leczenia brodawek, ran, zainfekowanych paznokci, owrzodzeń jamy ustnej nosa i krwawienia. Mieszanka Agno3-Kno3 Cauteriza Skóra niszcząca uszkodzoną tkankę i bakterie.
Bakteriobójcze działanie Agno3 Został również używany w oczyszczaniu wody.
Toksyczność i skutki uboczne
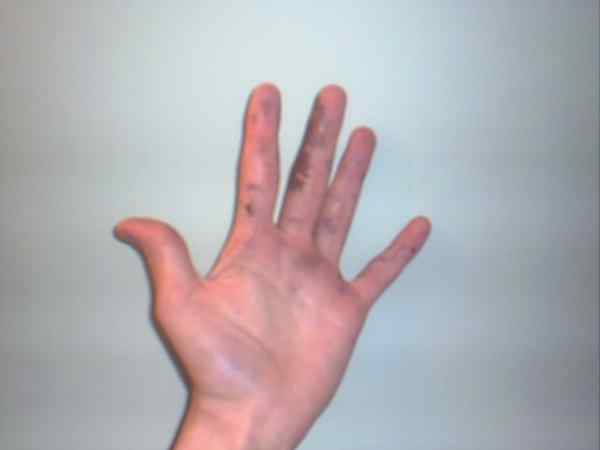 Azotan srebra może powodować oparzenia wyświetlane przez ich fioletowe lub ciemne plamy. Źródło: Jane z Baden w Anglii Wikipedia / domena publiczna
Azotan srebra może powodować oparzenia wyświetlane przez ich fioletowe lub ciemne plamy. Źródło: Jane z Baden w Anglii Wikipedia / domena publiczna Chociaż azotan srebra jest stabilną pensją i nie reprezentuje zbyt wielu zagrożeń, jest to wysoce żrące stałe, których spożycie może powodować poważne uszkodzenie przewodu pokarmowego.
Dlatego zaleca się manipulację rękawiczkami. Może spalić skórę, aw niektórych przypadkach przyciemniła ją, aż odwróci fioletę, stan lub chorobę znaną jako argiria.
Bibliografia
- Shiver & Atkins. (2008). Chemia nieorganiczna. (Czwarta edycja). MC Graw Hill.
- Wikipedia. (2020). Azotan srebra. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Azotan srebra. Baza danych Pubchem., CID = 24470. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Elsevier b.V. (2020). Azotan srebra. Scientedirect. Pobrano z: Scientedirect.com
- University of Iowa. (2020). Zastosowanie azotanu srebra i toksyczność. Odzyskane z: medycyny.Uiowa.Edu
- P.F. Lindley i p. Woodward. (1966). Jakiś X-Badania Raya azotanu srebra: unikalna struktura azotanu metalu. Journal of the Chemical Society A: Inorganic, Fizyczne, teoretyczne.
- Lucy Bell Young. (2020). Jakie są medyczne zastosowania azotanu srebra. Chemikalia odczynników. Odzyskane z: chemikalia.współ.Wielka Brytania

