Struktura piperydyny, synteza, pochodne, reakcje
- 2205
- 623
- Prokul Woliński
Piperydyna Jest to związek organiczny, którego skondensowana formuła jest (ch2)5NH. Składa się z cyklicznej wtórnej aminy, w której grupa aminowa, NH, jest częścią sześciokątnego pierścienia, który jest heterocykliczny, ze względu na obecność atomu azotu.
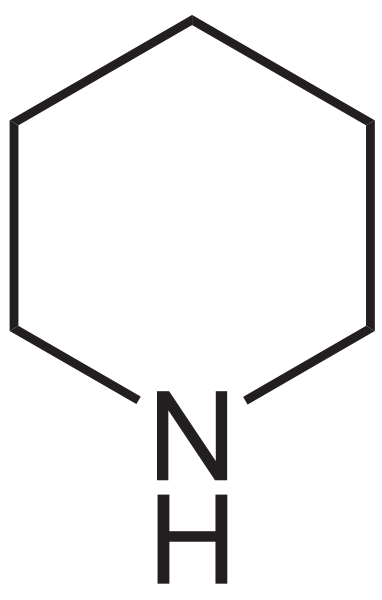
Piperydyna staje się azotową wersją cykloheksanu. Na przykład, na dolnym obrazie zwróć uwagę na formułę strukturalną piperydyny: jest bardzo podobna do cykloheksanu, z jedyną różnicą, że jedna z grup metylenowych, CHO2, został zastąpiony przez NH.
 Strukturalna formuła piperydyny. Źródło: Neuropoger / domena publiczna
Strukturalna formuła piperydyny. Źródło: Neuropoger / domena publiczna Ciekawa nazwa tej aminy pochodzi od łacińskiego słowa „piper”, co oznacza pieprz, ponieważ był on w czarnej pieprzu, gdzie po raz pierwszy został znaleziony i zsyntetyzowany. W rzeczywistości aromat piperydyny jest zdezorientowany aromatem mieszanki pieprzu i ryb.
Jego sześciokątny i heterocykliczny pierścień jest również prezentowany w wielu alkaloidach i lekach, więc piperydyna jest przeznaczona do organicznej syntezy takich produktów; takie jak morfina, ministeria i upodobanie.
[TOC]
Struktura
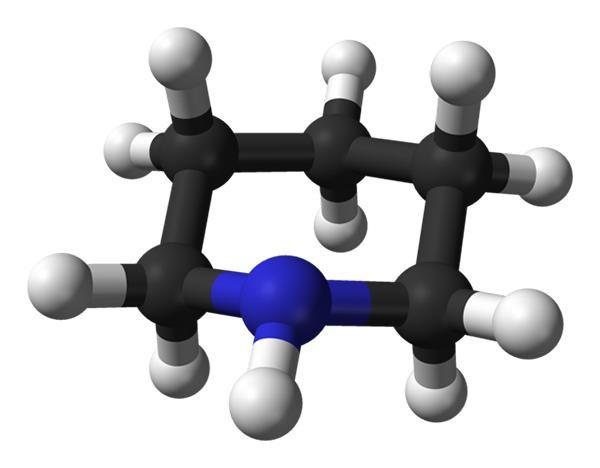 Struktura molekularna piperydyny. Źródło: Benjah-BMM27 / Public Domena
Struktura molekularna piperydyny. Źródło: Benjah-BMM27 / Public Domena Na górnym obrazie mamy strukturę molekularną piperydyny, reprezentowaną przez model kulek i prętów. Czarne kule, odpowiadające atomom węgla, tworzą szkielet, który byłby taki sam z cykloheksan.
Tutaj możesz zobaczyć pięć jednostek metylenowych, ch2, i sposób, w jaki ułożone są ich atomy wodoru. Podobnie, wtórna grupa aminowa jest wyraźnie obserwowana, której azot elektryczny przyczynia się do polaryzacji do cząsteczki.
Może ci służyć: korzyści z chemii dla społeczeństwaDlatego piperydyna ma stały moment dipolowy, w którym ujemna gęstość obciążenia jest skoncentrowana wokół NH.
Dzięki mmurce piperydyny dipolowej, jej siły międzycząsteczkowe lub interakcje są głównie typu dipol-dipolo.
Wśród interakcji Dipolo-Dipolo występują mosty wodorowe ustalone przez grupy NH-NH sąsiednich cząsteczek piperydyny. W rezultacie kohezja cząsteczek piperydyny w cieczy, która wrze w temperaturze 106 ° C.
Konformacje
Heksagonalny pierścień piperydyny, podobnie jak cykloheksan, nie jest płaski: jego atomy wodoru na przemian w pozycjach osiowych (powyżej lub poniżej) i równikowe (skierowane w kierunku boków). Zatem piperydyna przyjmuje kilka konformacji przestrzennych, a krzesło jest najważniejsze i stabilne.
Poprzedni obraz pokazuje jeden z czterech możliwych konfóomerów, w których atom wodoru grupy NH znajduje się w pozycji równikowej; Podczas gdy moment obrotowy azotu -nie jest zlokalizowany w pozycji osiowej (w tym przypadku).
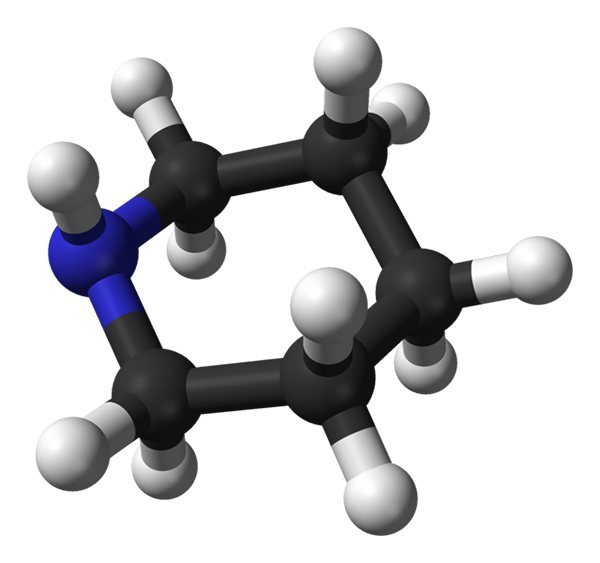 Konformacja osiowa piperydyny. Atom wodoru w pozycji osiowej zwiększa napięcie siostrzane na pierścieniu, ponieważ jest zbyt blisko innych hydrogenów osiowych i sąsiednich. Źródło: Benjah-BMM27 / Public Domena
Konformacja osiowa piperydyny. Atom wodoru w pozycji osiowej zwiększa napięcie siostrzane na pierścieniu, ponieważ jest zbyt blisko innych hydrogenów osiowych i sąsiednich. Źródło: Benjah-BMM27 / Public Domena Teraz pokazano inny ConfRuero (obraz wyższy), w którym tym razem atom wodoru grupy NH jest w pozycji osiowej (UP); i para elektronów nie ma azotu, w pozycji równikowej (po lewej).
Tak, że w sumie istnieją cztery konformery: dwa z wodorem NH w pozycjach osiowych i równikowych oraz dwa inne, w których względne pozycje azotu elektronów są zróżnicowane w odniesieniu do krzesła.
Może ci służyć: kwas seleenowy (H2SE): co to jest, struktura, właściwości, używaKonformery, w których wodór NH jest w pozycji równikowej, są najbardziej stabilne, ponieważ cierpią na niższe napięcia steryczne.
Synteza
Pierwsza synteza piperydyny. Piperina reaguje z kwasem azotowym, odłączając jednostkę heterocykliczną, której struktura została już przejrzana.
Jednak w skalach przemysłowych synteza piperydyny jest preferowana przez katalityczne uwodornienie pirydyny:
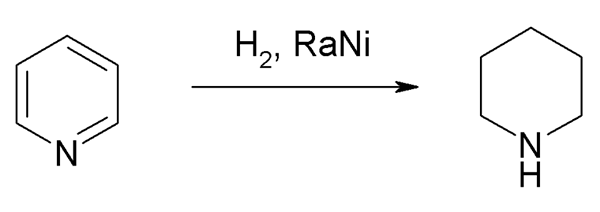 Uwodornienie pirydyny w celu uzyskania piperydyny. Źródło: Steffen 962 Via Wikipedia.
Uwodornienie pirydyny w celu uzyskania piperydyny. Źródło: Steffen 962 Via Wikipedia. Hydogens, h2, Dołączają do pierścienia pirydyny, łamiąc swój układ aromatyczny, dla którego potrzebna jest pomoc metalowych katalizatorów.
Pochodne
Piperina
Znacznie ważniejsze niż sama piperydyna, jest jej jednostka strukturalna, rozpoznawalna w niezliczonych alkaloidach i substancjach pochodzenia roślinnego. Na przykład poniżej masz strukturę molekularną piperyny:
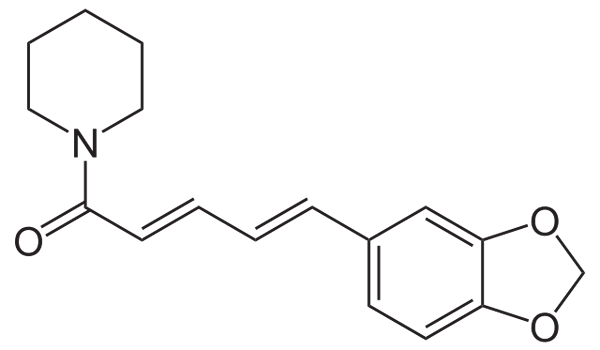 Strukturalna formuła piperyny. Źródło: Neuropoger przez Wikipedia.
Strukturalna formuła piperyny. Źródło: Neuropoger przez Wikipedia. Piperina ma wysoce sprzężoną konstrukcję; Oznacza to, że ma kilka podwójnych linków koordynowanych ze sobą, które pochłaniają promieniowanie elektromagnetyczne i które w taki czy inny sposób sprawiają, że jest to związek nietoksyczny do spożycia ludzi. Jeśli tak, czarny pieprz byłby trujący.
Coniína
Heterocykliczny i sześciokątny pierścień piperydyny występuje również w Coní, neurotoksynie wydobywanej z gojenia, odpowiedzialnego za jego nieprzyjemny zapach, który został również użyty do zatrucia. Jego struktura to:
Może ci służyć: amides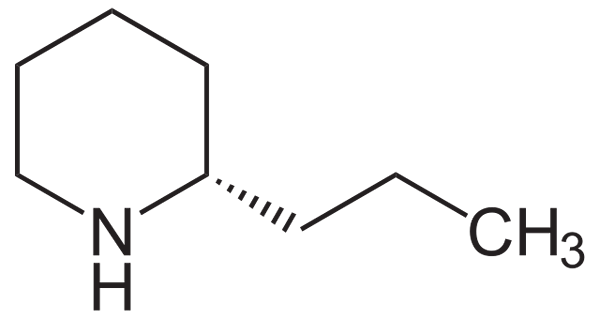 Formuła strukturalna coniína. Źródło: Neuropoger / domena publiczna
Formuła strukturalna coniína. Źródło: Neuropoger / domena publiczna Należy zauważyć, że coniína prawie nie różni się od piperydyny przez obecność podstawnika propylowego w węglu sąsiadującym z grupą NH.
Zatem pochodne piperydyny są uzyskiwane przez zastąpienie hydrożenów pierścienia lub wodoru tej samej grupy NH, innymi grupami molekularnymi lub fragmentami.
Morfina
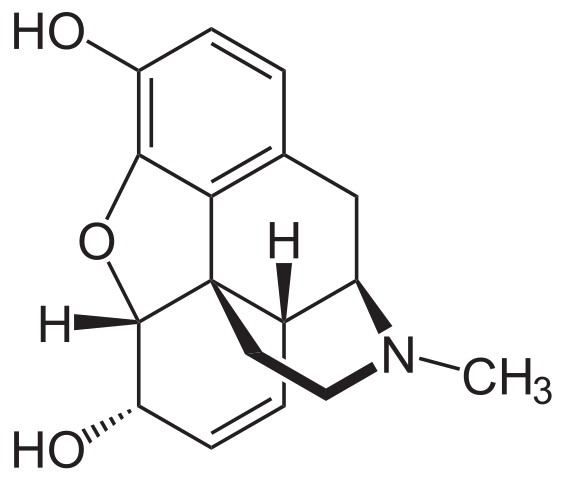 Strukturalna formuła morfiny. Źródło: Neuropoger / domena publiczna
Strukturalna formuła morfiny. Źródło: Neuropoger / domena publiczna Morfina to kolejne naturalne pochodne piperydyny. Tym razem pierścień piperydyny jest połączony z innymi pierścieniami i wskazuje na płaszczyznę, w kierunku obserwatora. Jest zidentyfikowane, ponieważ tworzy związek z grupą CHO3.
Narkotyki
Piperydyna i jej pochodne są stosowane do projektowania i syntezy różnych rodzajów leków. Dlatego są syntetycznymi pochodnymi piperydyny. Trzy z nich są następnie wymienione wraz z odpowiednimi formułami strukturalnymi:
 Risperidon, atypowy leki przeciwpsychotyczne przepisane do leczenia wielu zaburzeń psychicznych. Źródło: Fvasconcellos (Talk • Wpiss) / Public Domena
Risperidon, atypowy leki przeciwpsychotyczne przepisane do leczenia wielu zaburzeń psychicznych. Źródło: Fvasconcellos (Talk • Wpiss) / Public Domena  Minoxidil, rozszerzanie naczyń zwykle stosowane w radzeniu sobie z łysieniem. Źródło: Szczepienia / domena publiczna
Minoxidil, rozszerzanie naczyń zwykle stosowane w radzeniu sobie z łysieniem. Źródło: Szczepienia / domena publiczna  Ikarydyna lub pikarydyna, środek odstraszający owady, który komponuje sformułowanie ofert. Źródło: Arrowsmaster/CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0)
Ikarydyna lub pikarydyna, środek odstraszający owady, który komponuje sformułowanie ofert. Źródło: Arrowsmaster/CC BY-S (https: // creativeCommons.Org/licencje/nabrzeże/4.0) Bibliografia
- Graham Solomons t.W., Craig b. Fryhle. (2011). Chemia organiczna. (10th Wydanie.). Wiley Plus.
- Carey f. (2008). Chemia organiczna. (Szósta edycja). MC Graw Hill.
- Morrison i Boyd. (1987). Chemia organiczna. (Piąta edycja). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Piperydyna. Źródło: w:.Wikipedia.org
- National Center for Biotechnology Information. (2020). Piperydyna. Baza danych Pubchem., CID = 8082. Odzyskane z: Pubchem.NCBI.NLM.Nih.Gov
- Elsevier b.V. (2020). Piperydyna. Scientedirect. Pobrano z: Scientedirect.com
- Harold d. Banki. (1992). Synteza piperydyny. [PDF]. Odzyskane z: aplikacji.Dykt.tysiąc
- « Struktura poliwilupirolidonu, właściwości, zastosowania, skutki uboczne
- Struktura azotanu srebra (AGNO3), właściwości, zastosowania, toksyczność »

