Azotan miedziany (ii)
- 1491
- 239
- Maksymilian Kępa
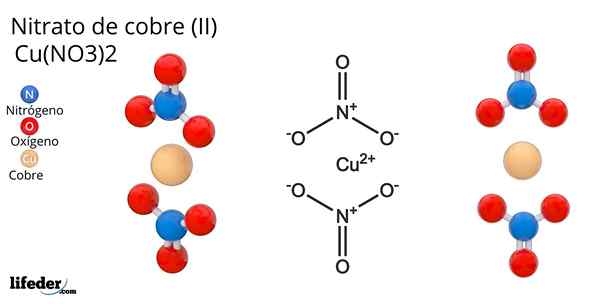
 Wzór i struktura azotanu miedzi (II)
Wzór i struktura azotanu miedzi (II) On azotan miedziany (Ii) lub azotan kupowy, którego wzór chemiczny to Cu (no3)2, Jest to genialna nieorganiczna sól i atrakcyjne niebiesko-zielone kolory. Jest syntetyzowany w skali przemysłowej z rozkładu minerałów miedzi, w tym Gerhardita i Rouaita Minerals.
Inne bardziej wykonalne metody, pod względem surowca i pożądanych ilości soli, składają się z bezpośrednich reakcji z metalową miedzią i jej pochodnymi związkami. Gdy miedź styka się ze skoncentrowanym roztworem kwasu azotowego (HNO3), następuje reakcja redoks.
W tej reakcji miedź utlenia się i azot jest zmniejszony zgodnie z następującym równaniem chemicznym:
Cu (y) + 4hno3(conc) => cu (nie3)2(AC) + 2H2Lub (l) + 2no2(G)
Dwutlenek azotu (nie2) jest brązowym i szkodliwym gazem; Powstały wodny roztwór jest niebieskawy. Miedź może tworzyć jon miedzi (cu+), Jon cuprowy (cu2+) lub najmniej powszechny jon cu3+; Jednak jon miedziony nie jest faworyzowany w pożywkach wodnych przez wiele czynników elektronicznych, energii i geometrycznych.
Standardowy potencjał redukcji Cu+ (0,52 V) jest większe niż dla Cu2+ (0,34 V), co oznacza, że Cu+ Jest bardziej niestabilny i ma tendencję do wygrania elektronu, aby stać się Cu (. Ten środek elektrochemii wyjaśnia, dlaczego nie ma cuno3 jako produkt reakcji lub przynajmniej w wodzie.
[TOC]
Właściwości azotanu miedzi
 Wygląd azotanu miedzi (ii) triohydrat
Wygląd azotanu miedzi (ii) triohydrat Azotan miedziany jest bezwodnikiem (suchym) lub uwodnionym z różnymi proporcjami wody. Nieustęp jest niebieski ciecz, ale po koordynacji z cząsteczkami wody - zdolny do tworzenia mostów wodoru - krystalizuje sposób, w jaki Cu (nie3)2· 3H2O o cu (nie3)2· 6H2ALBO. Są to trzy najbardziej dostępne formy soli na rynku.
Może ci służyć: Helmholtz Free Energy: Jednostki, sposób jej obliczania, rozwiązywane ćwiczeniaMasa cząsteczkowa dla suchej soli wynosi 187,6 g/mol, dodając do tej wartości 18 g/mol dla każdej cząsteczki wody włączonej do soli. Jego gęstość jest równa 3,05 g/ml i zmniejsza się o każdą wbudowaną cząsteczkę wody: 2,32 g/ml dla soli trójhydrowanej i 2,07 g/ml dla heksagańskiej soli solnej. Nie ma temperatury wrzenia, ale Sublima.
Trzy formy azotanu miedzianego są wysoce rozpuszczalne w wodzie, amoniaku, dioksanie i etanolu. Jego punkty topnienia schodzą, gdy inna cząsteczka jest dodawana do zewnętrznej sfery koordynacyjnej miedzi; Po fuzji następuje termiczny rozkład azotanu miedzianego, wytwarzając szkodliwe gazy NO2:
2 Cu (nie3)2(s) => 2 cuo (s) + 4 nie2(g)+ lub2(G)
Powyższe równanie chemiczne dotyczy soli bezwodnika; W przypadku uwodnionych soli pary wodne wystąpi również po prawej stronie równania.
Elektroniczna Konfiguracja
Konfiguracja elektroniczna dla jonowych cu2+ To jest [AR] 3D9, Prezentowanie paramagnetyzmu (elektron w 3D Orbital9 jest zniknięty).
Ponieważ miedź jest metalem przejściowym czwartego okresu okresowego tabeli i stracił dwa elektrony Valencia na działanie HNO3, Nadal ma dostępne orbitale 4 i 4p do tworzenia kowalencyjnych obligacji. Co więcej, Cu2+ Możesz użyć dwóch najbardziej zewnętrznych orbitali 4D, aby móc koordynować do sześciu cząsteczek.
Aniony nie3- Są płaskie i dla Cu2+ Możesz z nimi koordynować, musi mieć hybrydyzację SP3D2 To pozwala na przyjęcie geometrii oktaedrycznej; To nie zapobiega anionom3- Bądź wśród nich „trafieniem”.
Może ci służyć: formuła skondensowana: co to jest i przykłady (metan, etan, glukoza ...)Jest to osiągane przez Cu2+, umieszczanie ich w kwadratowej płaszczyźnie wokół siebie. Powstała konfiguracja atomu Cu w soli to: [AR] 3D94s24p6.
Struktura chemiczna
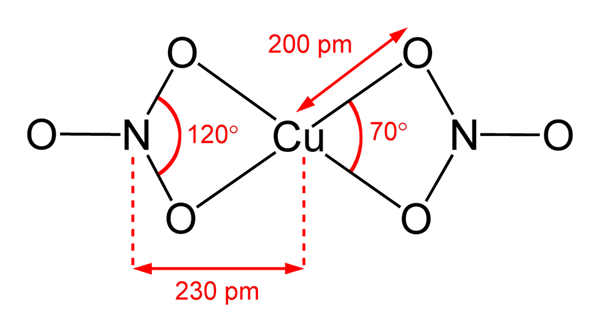 Struktura azotanu miedzi (ii)
Struktura azotanu miedzi (ii) Na górnym obrazie reprezentowana jest izolowana cząsteczka Cu (nie3)2 w fazie gazowej. Atomy tlenu anionowego azotanu są bezpośrednio skoordynowane z centrum miedzi (wewnętrzna sfera koordynacyjna), tworząc cztery wiązania Cu-O.
Ma geometrię cząsteczkową płaszczyzny kwadratowej. Płaszczyznę jest rysowana przez czerwone kule w wierzchołkach i kuli miedzianej w środku. Interakcje z fazą gazową są bardzo słabe z powodu odpychania elektrostatycznego między grupami3-.
Jednak w fazie stałej centra miedzi tworzą metalowe łącza-CU-CU-, tworząc polimerowe łańcuchy miedzianckie.
Cząsteczki wody mogą tworzyć mosty wodorowe z grupami3-, I będą oferować mosty wodorowe dla innych cząsteczek wody i tak dalej, aż do kuli wody wokół Cu (nie3)2.
W tej sferze może mieć 1 do 6 zewnętrznych sąsiadów; Stąd sól można łatwo nawodnić, aby wytworzyć uwodnione sole TRI i sześciokątne.
Sól powstaje z jonowego cu2+ i dwa jony nie3-, Przyznaje charakterystyczną krystaliczność związków jonowych (ortorrombic dla soli bezwodnej, Rhomboédica dla soli uwodnionych). Jednak linki mają większy charakter kowalencyjny.
Używa/aplikacje
W przypadku fascynujących kolorów azotanu miedzianego ta sól znajduje się jako addytyw w ceramice, na metalicznych powierzchniach, w niektórych fajerwerkach, a także w przemyśle tekstylnym jako mordant.
Może ci służyć: entalpiaJest to dobre źródło jonowe dla wielu reakcji, zwłaszcza tych, w których katalizuje reakcje organiczne. Znajduje również podobne zastosowania do innych azotanów, albo jako grzybobójczy, herbicydu lub jako drewniany konserwujący.
Kolejnym z jego głównych i najbardziej nowych zastosowań jest synteza katalizatorów CUO lub materiałów o światłoczułych cechach.
Jest również stosowany jako klasyczny odczynnik w nauczaniu laboratoriów w celu wykazania reakcji wewnątrz komórek woltowych.
Ryzyko
- Jest to silnie utleniający środek, szkodliwy dla morskiego, irytującego, toksycznego i żrących ekosystemu. Ważne jest, aby uniknąć całego fizycznego kontaktu bezpośrednio z odczynnikiem.
- To nie jest łatwopalne.
- Rozkłada się w wysokich temperaturach uwalniających irytujące gazy, wśród nich2.
- W organizmie ludzkim może powodować przewlekłe uszkodzenie centralnego układu sercowo -naczyniowego i nerwowego.
- Może powodować podrażnienia w przewodzie pokarmowym.
- Będąc azotanem, w ciele staje się azotynem. Azotyn podnosi spustoszenie w poziomach tlenu we krwi i układzie sercowo -naczyniowym.
Bibliografia
- Dzień, r., & Underwood, a. Ilościowa chemia analityczna (Ed.). Pearson Prentice Hall, P-810.
- Mel Science. (2015-2017). Mel Science. Odzyskane z Mel Science: Melscience.com
- ResearchGate GmbH. (2008-2018). Researchgate. Odzyskane z Researchgate: Researchgate.internet
- Laboratorium naukowe. Laboratorium naukowe. Odzyskane z Laboratorium Science: Sciencelab.com
- Whitten, Davis, Peck i Stanley. (2008). Chemia (Ósmy ed.). P-321. Cengage Learning.
- Wikipedia. Wikipedia. Wikipedia wyzdrowiała: w.Wikipedia.org

