Metody rozdziału jednorodnych mieszanin
- 1530
- 346
- Pani Waleria Marek
Metody rozdziału jednorodnych mieszanin Są to wszyscy, którzy bez stosowania reakcji chemicznych pozwalają na uzyskanie komponentów lub substancji rozpuszczonych, które integrują tę samą fazę; to znaczy cieczy, stałego lub gazowego.
Takie jednorodne mieszanki składają się z roztworów, w których cząstki substancji rozpuszczonej są zbyt małe, aby móc je odróżnić nagim okiem. Są tak małe, że nie ma wąskich ani selektywnych filtrów, aby je zatrzymać, podczas gdy rozwiązanie je przenosi. Techniki, takie jak wirowanie lub magnetyzacja.
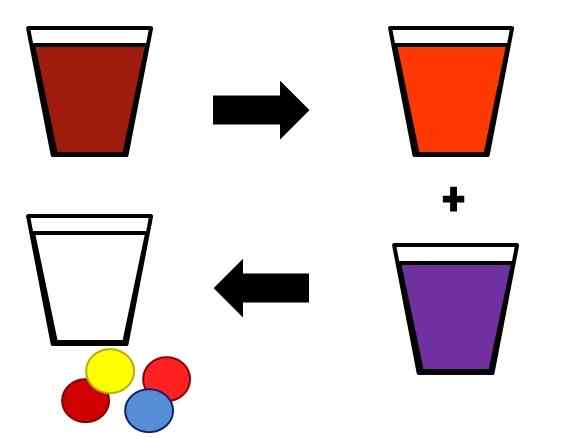 Ilustracyjny przykład tego, jak jednorodne mieszanki mogą się oddzielić etapami. Źródło: Gabriel Bolívar.
Ilustracyjny przykład tego, jak jednorodne mieszanki mogą się oddzielić etapami. Źródło: Gabriel Bolívar. Przykład, w jaki sposób rozwiązania są rozdzielone w ich komponentach, pokazano powyżej. Początkowa mieszanina (brązowa) jest podzielona na dwa elementy, równie jednorodne (pomarańczowe i fioletowe). Wreszcie, z dwóch powstałych mieszanin, uzyskiwane są rozpuszczalnik (biały) i cztery odpowiednie pary substancji rozpuszczonych (czerwono-żółty i czerwony niebieski).
Wśród metod lub technik rozdziału roztworów mamy odparowanie, destylacja, chromatografia i krystalizacja ułamkowa. W zależności od złożoności mieszaniny należy użyć więcej niż jednej z tych metod, dopóki nie złamie jednorodności.
[TOC]
Główne metody rozdziału mieszanin
- Odparowanie
 Parowanie jest najprostszą metodą oddzielenia jednorodnych mieszanin od pojedynczej substancji rozpuszczonej.
Parowanie jest najprostszą metodą oddzielenia jednorodnych mieszanin od pojedynczej substancji rozpuszczonej. Najprostsze jednorodne mieszanki to rozwiązania, w których rozpuszczono pojedynczą substancję substancji rozpuszczonej. Na przykład na obrazie górnym istnieje kolorowe rozwiązanie ze względu na wchłanianie i odbicie światła widzialnego z cząstkami jego substancji rozpuszczonej.
Jeśli dobrze się poruszył podczas jego przygotowania, nie będzie wyraźniejszych ani ciemnych regionów niż inne; Wszystkie są takie same, mundury. Takich kolorowych cząstek nie można oddzielić od rozpuszczalnika jakąkolwiek metodą mechaniczną, więc potrzebujesz energii w cieple (czerwony trójkąt), aby ją osiągnąć.
Może ci służyć: disiarczde węglowe (CS2): struktura, właściwości, zastosowania, ryzykoZatem kolorowe roztwór jest ogrzewane na otwartym czasie, aby przyspieszyć i umożliwić odparowanie rozpuszczalnika poza jego pojemnikiem. Jak się zdarza, objętość oddzielająca cząstki substancji rozpuszczonej zmniejsza się, a zatem jej interakcje wzrastają i kończą powoli osadowe.
Ostatecznym rezultatem jest to, że kolorowa substancja rozpuszczona pozostaje na dole pojemnika, a rozpuszczalnik całkowicie odparował.
Niedogodności związane z odparowaniem jest to, że zamiast oddzielić substancje rozpuszczone, jego celem jest wyeliminowanie rozpuszczalnika poprzez podgrzewanie go do temperatury wrzenia. Pozostała substancja stała może składać się z więcej niż jednej substancji rozpuszczonej i dlatego jest wymagana z innych metod separacji, aby zdefiniować ją w izolowanych komponentach.
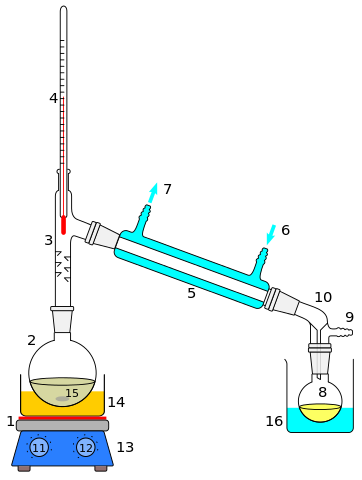
- Destylacja
 Destylacja
Destylacja Destylacja jest być może metodą rozdziału jednorodnych roztworów lub mieszanin. Jego zastosowanie rozciąga się na stopione sole lub metale, gazy skondensowane, mieszanki rozpuszczalników lub ekstrakty organiczne. Substancja rozpuszczona jest w większości przypadków ciecz, której temperatura wrzenia różni się w kilku stopniach w odniesieniu do rozpuszczalnika.
Gdy różnica między takimi temperaturami wrzenia jest wysoka (większa niż 70 ° C), stosuje się prostą destylację; A jeśli nie, wówczas wykonuje się destylację ułamkową. Obie destylacje mają wiele zespołów lub wzorów, a także inną metodologię mieszanin o różnym charakterze chemicznym (lotne, reaktywne, polarne, apolarne itp.).
W destylacji zarówno rozpuszczalnik, jak i substancje rozpuszczalne są zachowane, a jest to jedna z jego głównych różnic dotyczących odparowania.
Jednak Rotaevaporation łączy te dwa aspekty: mieszaninę cieczowo-stała lub ciecz-ciecz, taką jak rozpuszczony i mieszalny olej, ogrzewa się do momentu usunięcia rozpuszczalnika, ale jest zbierana w innym pojemniku, podczas gdy stał lub stał Olej pozostaje w początkowym pojemniku.
Może ci służyć: okresowy stół, po co to jestDestylacja powietrza
Powietrze kondensatowe podlega kriogenicznej destylacji frakcyjnej w celu oddzielenia tlenu, azotu, argonu, neonu itp. Powietrze, jednorodna mieszanka gazowa, jest przekształcane w ciecz, w którym azot, ponieważ jest to składnik większości, działa teoretycznie jako rozpuszczalnik; A inne gazy, również skondensowane, jako ciekłe substancje rozpuszczone.
- Chromatografia
Chromatografia, w przeciwieństwie do innych technik, nie może zapewnić plonów lub zdalnie podobnych; Oznacza to, że nie jest przydatne przetwarzanie całej mieszanki, ale nieistotna ułamek tego samego. Jednak informacje, które podaje, są cenne analitycznie, ponieważ identyfikuje i klasyfikuje mieszaniny na podstawie jego składu.
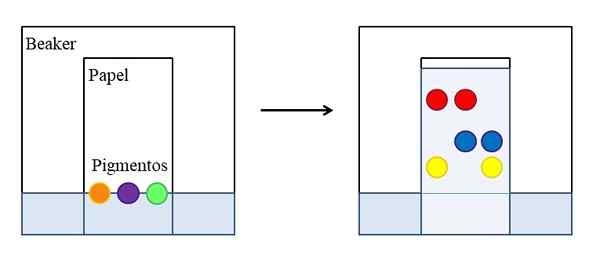 Papierowa lub cienkie chromatografia warstwy. Źródło: Gabriel Bolívar.
Papierowa lub cienkie chromatografia warstwy. Źródło: Gabriel Bolívar. Istnieją różne rodzaje chromatografii, ale najprostsze, które są wyjaśnione w szkołach lub kursach przednichodawczych, jest papier, którego zasada jest taka sama jak ta opracowana na cienkiej warstwie materiału pochłaniającego (powszechnie żel krzemionkowy ).
Górny obraz pokazuje, że w zlewce, pełnej wody lub określonego rozpuszczalnika, umieszczany jest papier oznaczony jako linia odniesienia z kroplami lub punktami trzech wybranych pigmentów (pomarańczowy, fioletowy i zielony). Zlewka pozostaje zamknięta, tak że ciśnienie jest stałe i nasyca się od oparów rozpuszczalników.
Następnie płyn zaczyna wspinać się przez papier i przeciągają pigmenty. Interakcje z pigmentowo-pale nie są takie same: niektóre są silniejsze i inne słabsze. Im więcej powinowactwa pigment odczuwa papier, tym mniej wzrośnie przez papier w odniesieniu do linii, która została początkowo oznaczona.
Może ci służyć: stała prędkościNa przykład: czerwony pigment jest tym, który czuje mniej powinowactwa do rozpuszczalnika, podczas gdy żółty ledwo wzniesiony, ponieważ papier zachowuje go więcej. Następnie mówi się, że rozpuszczalnik jest fazą ruchomą, a papier jest fazą stacjonarną.
- Krystalizacja ułamkowa
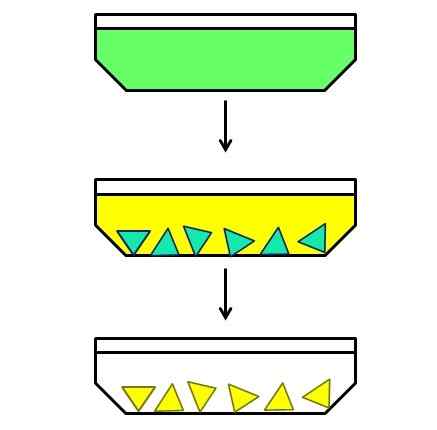 Ilustracyjny przykład frakcyjnej krystalizacji. Źródło: Gabriel Bolívar.
Ilustracyjny przykład frakcyjnej krystalizacji. Źródło: Gabriel Bolívar. I wreszcie masz ułamkową krystalizację. Ta metoda może być może katalogować jak hybryda, ponieważ zaczyna się od jednorodnej mieszanki, aby zakończyć heterogeniczną. Załóżmy na przykład, że istnieje rozwiązanie, w którym rozpuszczono zieloną substancję stałą (obraz doskonały).
Zielone cząstki są zbyt małe, aby oddzielić ręcznie lub mechanicznie. Chodzi również o to, że zielona substancja stała jest mieszaniną dwóch składników, a nie jednym z nich w tym kolorze.
Następnie jego roztwór jest podgrzewany i pozostawiony w spoczynku podczas chłodzenia. Okazuje się, że dwa elementy, choć bardzo powiązane ze sobą, ich rozpuszczalnik rozpuszczalnika jest nieco inny; Dlatego jeden z nich zacznie najpierw krystalizować, a następnie drugi.
Zielona niebieska składnik (na środku obrazu) jest pierwszym, który krystalizował, podczas gdy żółty składnik jest nadal rozpuszczony. Będąc zielonymi niebieskimi kryształami, są gorące, zanim pojawią się żółte kryształy. Następnie, gdy rozpuszczalnik ostygnie nieco bardziej, żółty krystalizuje się i wykonano kolejną filtrację.
Interesujące tematy
Metody separacji mieszanki.
Metody rozdziału heterogenicznych mieszanin.
Mieszanki: komponenty i typy.
Mieszanki jednorodne.
Heterogeniczne mieszanki.
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Chelsea Schuyler. (2019). Chromatografia, destylion i filtrion: Metody oddzielania mieszanin. Badanie. Odzyskane z: Study.com
- Fundacja CK-12. (16 października 2019). Metody oddzielania mieszanin. Chemia librettexts. Odzyskane z: chem.Librettexts.org
- Dobra nauka. (2019). Oddzielenie mieszanin. Odzyskane z: GoodScience.com.Au
- Clark Jim. (2007). Chromatografia cienkowarstwowa. Odzyskane z: chemguide.współ.Wielka Brytania
- « Obiecana (PM) struktura, właściwości, uzyskiwanie, zastosowania
- Charakterystyka funkcji metalingwistycznej, funkcje i przykłady »

