Cząsteczki apolowe
- 1350
- 354
- Maksymilian Kępa
Cząsteczki apolowe Są tymi, którzy obecni w swojej strukturze symetryczny rozkład swoich elektronów. Jest to możliwe, jeśli różnica elektroungatywności jego atomów jest niewielka lub jeśli atomy lub grupy elektroungatywne anulują ich wpływ na cząsteczkę.
Nie zawsze „apolarność” jest absolutna. Z tego powodu złe cząsteczki polarności są uważane za apolarne; to znaczy ma moment dipolowy µ bliski 0. Tutaj wchodzisz do pola względnego: jak niski powinien być µ, aby cząsteczka lub związek był uważany za apolowy?
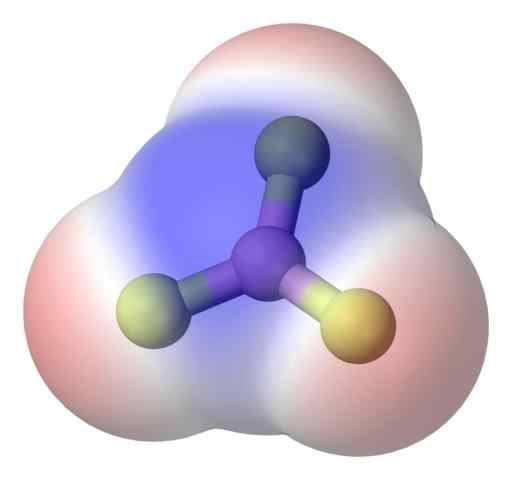
 Cząsteczka apolarna BF3. Źródło: Benjah-BMM27 przez Commons Wikimedia.
Cząsteczka apolarna BF3. Źródło: Benjah-BMM27 przez Commons Wikimedia. Aby lepiej rozwiązać ten problem, masz cząsteczkę boru trifluorku, BF3 (obraz górny).
Atom fluorowy jest znacznie bardziej elektroungcyjny niż Boro, a zatem łącza B-F są polarne. Jednak cząsteczka BF3 Jest symetryczny (płaszczyzna trygonalna) i pociąga za sobą anulowanie wektora trzech momentów B-F.
Zatem generowane są również cząsteczki apolarne, nawet w przypadku istnienia linków polarnych. Wygenerowana polaryzacja może być zrównoważona przez istnienie innego łącza polarnego o tej samej wielkości co poprzednia, ale zorientowana w przeciwnym kierunku; tak jak w przypadku BF3.
Charakterystyka cząsteczki apolarnej
Symetria
Aby skutki linków polarnych do wzajemnego anulowania, cząsteczka musi mieć specyficzną strukturę geometryczną; Na przykład liniowy, najłatwiejszy do zrozumienia na pierwszy rzut oka.
Tak jest w przypadku dwutlenku węgla (CO2), który ma dwa łącza polarne (o = c = o). Wynika to z faktu, że dwa momenty dipolowe linków c = o są anulowane, gdy jedno jest zorientowane na jedną stronę, a drugą w drugim, pod kątem 180 °.
Może ci służyć: transaminacjaDlatego jedną z pierwszych cech, które należy wziąć pod uwagę, gdy „apolarność” cząsteczki jest oceniana przez lot ptaków, jest obserwowanie, jak symetryczne jest to.
Załóżmy, że zamiast CO2 Masz cząsteczkę cos (o = c = s), zwany siarkowym karbonylowym.
Teraz nie jest już cząsteczką apolarną, ponieważ elektroonegatywność siarki jest mniejsza niż tlen; I dlatego moment dipolowy c = s różni się od c = o. W rezultacie COS jest cząsteczką polarną (polarna jest mąką z innego worka).
Niższy obraz graficznie podsumowuje wszystko, co nowo opisane:
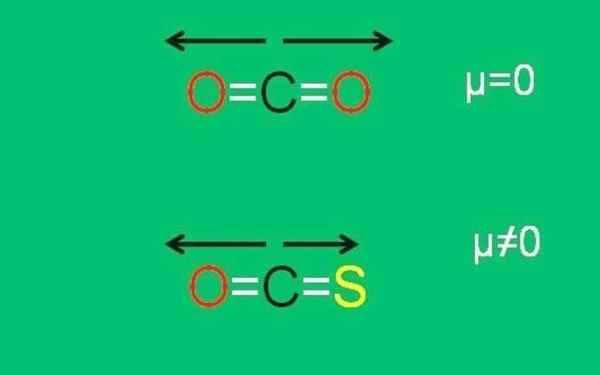 Xxx dipolarne momenty cząsteczek CO2 i COS. Źródło: Gabriel Bolívar.
Xxx dipolarne momenty cząsteczek CO2 i COS. Źródło: Gabriel Bolívar. Zauważ, że moment dipolowy linku c = s jest mniejszy niż link c = o w cząsteczce COS.
Elektronialiczność
Electroneza w skali Paulinga ma wartości między 0,65 (dla Francio) do 4,0 (dla fluorku). Zasadniczo halogeny mają wysoką elektrooniczność.
Gdy różnica w elektroonetronialiczności elementów, które tworzą wiązanie kowalencyjne, jest mniejsza niż 0,4, mówi się, że jest to apolarne lub nie polarne. Jednak jedynymi cząsteczkami, które są naprawdę apolarne, są te utworzone przez powiązania między identycznymi atomami (takimi jak wodór, H-H).
Siły międzycząsteczkowe
Aby substancja rozpuściła się w wodzie, musi oddziaływać elektrostatycznie z cząsteczkami; interakcje, które nie mogą wykonywać cząsteczek apolarnych.
W cząsteczkach apolarnych ich ładunki elektryczne nie są ograniczone na jednym końcu cząsteczki, ale symetrycznie rozłożone (lub jednorodnie). Dlatego nie jest w stanie wchodzić w interakcje poprzez siły dipola-dipolo.
Może ci służyć: objętość atomowaZamiast tego cząsteczki apolarne oddziałują ze sobą poprzez londyńskie siły dyspersji; Są to natychmiastowe dipole, które polaryzują elektroniczną chmurę atomów sąsiednich cząsteczek. Tutaj masa cząsteczkowa jest głównym czynnikiem we właściwościach fizycznych tych cząsteczek.
Jak zidentyfikować cząsteczki apolarne?
-Być może jedną z najlepszych metod identyfikacji cząsteczki apolarnej jest jej rozpuszczalność w różnych rozpuszczalnikach polarnych, ponieważ jest w nich niewielka rozpuszczalna.
-Zasadniczo cząsteczki apolarne mają charakter gazowy. Mogą to również być niemieszalne płyny z wodą.
-Solidne stałe charakteryzują się miękką.
-Siły dyspersji, które je utrzymują. Z tego powodu jego punkty topnienia lub wrzenia są zwykle niższe niż w przypadku związków polarnych.
-Cząsteczki apolarne, szczególnie w postaci cieczy, są złymi przewodami energii elektrycznej, ponieważ brakuje im ładunku elektrycznego netto.
Przykłady cząsteczek apolarnych
Gazy szlachetne
Chociaż nie są to cząsteczki, gazy szlachetne są uważane za apolarne. Jeśli założono, że dwa z jego atomów oddziałują przez krótkie okresy, interakcję tę można uznać (połowę) jako cząsteczka; Cząsteczka, która byłaby natura niepolarna.
Cząsteczki dwuatomiczne
Cząsteczki dwuatomiczne, takie jak H2, Br2, I2, Cl2, o2, i f2, Są apoliste. Są ogólnie2, A-A.
Węglowodory
Co jeśli byłaby to grupa atomów? Byłoby to przed innymi związkami apolarnymi; Na przykład Ethan, Cho3-Ch3, którego szkielet węglowy jest liniowy, C-C.
Metano, rozdz4, i etan, c2H6, Są to cząsteczki apolarne. Węgiel ma elektroujemność 2,55; Podczas gdy elektroonywność wodoru wynosi 2,2. Dlatego istnieje wektor dipolowy o niskiej intensywności, zorientowany z wodoru do węgla.
Może ci służyć: Metoda MOHR: Podstawy, reakcje, procedura, zastosowaniaAle ze względu na geometryczną symetrię cząsteczek metanu i etanu suma wektorów dipolowych lub momentów dipolowych w ich cząsteczkach jest nieważna, więc w cząsteczkach nie ma obciążenia netto w cząsteczkach.
Ogólnie rzecz biorąc, to samo dzieje się ze wszystkimi węglowodorami, a nawet gdy występuje w nich nienasycenie (wiązania podwójne i potrójne), są one uważane za apolowe lub związki o niskiej polarności. Również cykliczne węglowodory to cząsteczki apolarne, takie jak cykloheksan lub cyklobutan.
Inni
Cząsteczki dwutlenku węgla (CO2) i dwusiarczki węglowe (CS2) Są to cząsteczki apolarne, oba z geometrią liniową.
W disiarczku węgla elektroungatywność węgla wynosi 2,55, podczas gdy elektroonegatywność siarki wynosi 2,58; Tak więc oba elementy mają praktycznie tę samą elektroonywność. Nie ma generowania wektora dipolowego, a zatem obciążenie netto wynosi zero.
Dostępne są również następujące cząsteczki CCL4 i albr3, oba apolarne:
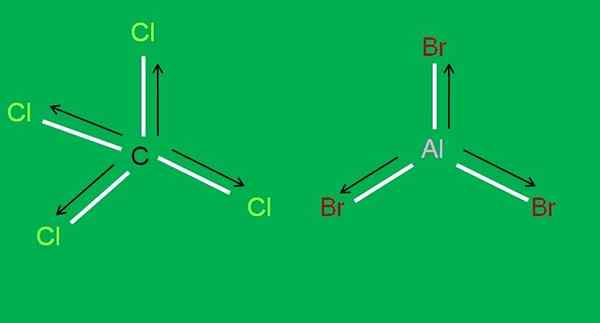 Cząsteczki CCL4 i ALBR3. Źródło: Gabriel Bolívar.
Cząsteczki CCL4 i ALBR3. Źródło: Gabriel Bolívar. W aluminiowym tribromidzie, albb3 To samo dzieje się z BF3, Na początku artykułu. Tymczasem dla tetrachlorku węgla, CCL4, Geometria jest czworościenna i symetryczna, ponieważ wszystkie łącza C-Cl są równe.
Podobnie cząsteczki o ogólnej wzorze CX4 (Por4, Ci4 i CBR4), są również apolarnymi.
I wreszcie, cząsteczka apolarna może nawet mieć oktaedalną geometrię, jak ma to miejsce w przypadku heksaklorku siarki, SF6. W rzeczywistości możesz mieć dowolną geometrię lub strukturę, o ile jest symetryczna, a jego rozkład elektroniczny jest jednorodny.
Bibliografia
- Niepolarna cząsteczka. Odzyskane z: chemii.Tutorvista.com
- Przykład cząsteczek polarnych i niepolarnych. Odzyskane z: Thoughtco.com
- « Równowaga materii Co to jest, równanie ogólne, typy
- Daniel Servitje Montull Biografia, przywództwo i wkład »

