Modyfikacje posttradutional
- 2422
- 289
- Prokul Woliński
Jakie są modyfikacje po -translacyjne?
Modyfikacje po -translacyjne są odwracalne lub nieodwracalne modyfikacje lub zmiany chemiczne.
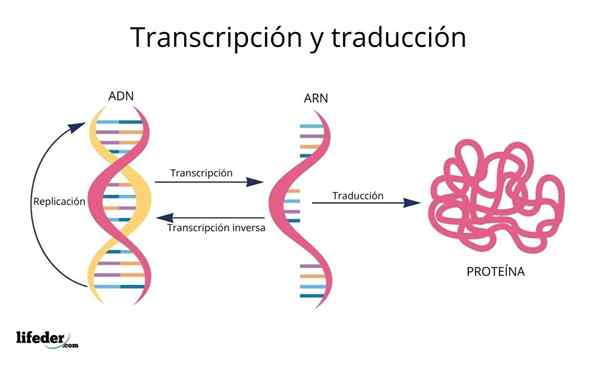
Tłumaczenie jest wynikiem „czytania i interpretacji” informacji zawartych w genach znalezionych w jądrze eukariotycznym (występuje również u prokariotów).
Zestaw genów komórki -genom- Właśnie tam instrukcje mają na celu wytwarzanie wszystkich białek strukturalnych i enzymów występujących w wnętrzu komórkowym, od których zależą procesy i funkcje życiowe każdej komórki.
Geny powstają przez DNA (kwas deoksyrybonukleinowy), który jest makrocząsteczką utworzoną przez dwa komplementarne łańcuchy polimeru złożone z 4 rodzajów różnych cząsteczek zwanych Podstawy azotu, Mianowicie: Adenina, Timina, Guanina i cytozyna.
DNA jest zatem rodzajem alfabet Z informacjami odczytanymi i przetłumaczonymi.
Przed tłumaczeniem informacje w DNA są pierwsze transkrybowane W jądrze do innej bardzo podobnej cząsteczki, RNA (kwas rybonukleinowy), w postaci zwanych cząsteczek Messenger RNA, które są później transportowane do cytosolu.
RNA jest bardzo podobny do DNA, ale powstaje przez pojedynczy łańcuch złożony z zasad adeniny, uracylu, guaniny i cytozyny.
RNA posłańca, pochodzące z sekwencji białek kodujących genetyczne, są następnie „odczytane”, a ich sekwencja jest przetłumaczony W sekwencjach peptydowych białek komórkowych za pomocą rybosomów i innych cząsteczek RNA znanych jako Przenieś RNA To, jak sama nazwa wskazuje, Przenoszą aminokwasy odpowiednie do syntetyzowanego białka.
Kolejność, w której aminokwasy są dodawane w powstających białkach, jest podyktowana sekwencją genów, które je kodują, to znaczy z rzędu zasad azotu w sekwencji DNA.
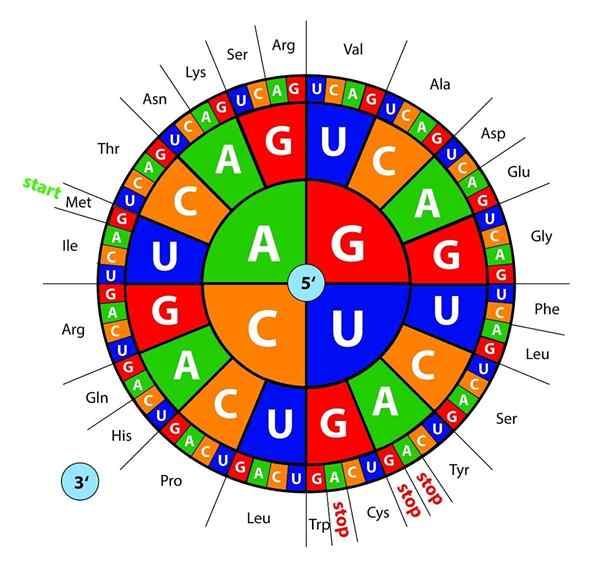
Podstawy DNA, transkrybowane jako RNA, są „odczytane” przez rybosomy w trio lub trojaczkach nazywanych kodony, Każdy z nich koduje dla jednego z 20 aminokwasów, z którymi powstają białka; Oto to kod genetyczny jest interpretowany do przedstawienia w odpowiedniej kolejności aminokwas w tym samym czasie.
Modyfikacje po -translacyjne
Większość charakterystyk fizykochemicznych i funkcjonalnych każdego białka zależy głównie od informacji zakodowanych w DNA.
Jednak komórki zdołają znacząco zwiększyć różnorodność swoich białek poprzez modyfikacje post -translacyjne, które są niczym więcej niż modyfikacjami chemicznymi - za pośrednictwem enzymów - które cierpią z niektórych białek po ich translacji.
Może ci służyć: glukoza oksydazy: charakterystyka, struktura, funkcjeDlatego cechy niektórych białek nie można wywnioskować wyłącznie z sekwencji aminokwasowej, która wywodzi się z informacji genetycznej.
Te modyfikacje zwykle występują na odpadach aminokwasowych, które powodują.
Opisano ponad 500 modyfikacji translacyjnych, ale z nich najbardziej znani i badani to fosforylacja, tworzenie mostów disiarczkowych, metylacja, acetylacja, hydroksylacja, glikozylacja, pranilacja, ubikwitynacja i karboksylacja.
Proces modyfikacji pozy
Jak skomentowaliśmy modyfikacje po -translacyjne, to modyfikacje chemiczne, które cierpią na białka komórkowe eukariotyczne po ich syntezy, to znaczy ich translacja.
Zasadniczo mają one związek z dodaniem grup chemicznych i/lub modyfikacją odpadów aminokwasowych, które tworzą białka, ale niektóre ważne modyfikacje mają również związek z ustaleniem wiązań między aminokwasami tego samego białka lub również z eliminacją aminokwasów o peptydy znaki za pomocą cięć lub Clivajes proteolityczny.
Te modyfikacje są możliwe dzięki obecności niektórych wyspecjalizowanych enzymów komórkowych, a ponadto małe podłoża energii - nie są to reakcje spontaniczne - jak na przykład:
- ATP (adenozyna 5-fosforan)
- Koenzym acetylu A (acetyl CO-A)
- NAD+ (5'-Nicinamid 5'-difosforan adenozyna)
- S-adenosil miionina (SAM)
- Uracyl 5'-difosforanu N-Acetylu glukozamina (UDP-grcNAc)
- Uracyl 5'-glukoza difosforan (UDP-glukoza)
- Pośród innych
Niektóre z najważniejszych modyfikacji post -translacyjnych działają jako przełączniki (Suiches) Molekularne, które aktywują lub dezaktywują funkcje enzymatyczne niektórych białek, regulując ich funkcję komórkową, a nawet lokalizację wewnątrzkomórkową.
Na przykład wiele białek należących do organelli wewnątrzkomórkowych jest syntetyzowane w cytosolu z końcami N-O-końcowymi, które odpowiadają Sekwencje sygnalizacyjne, które są rozpoznawane przez inne białka odpowiedzialne za skierowanie ich do odpowiedniego przedziału, a po drodze sygnały te są zwykle usuwane ze struktury białka.
Kolejnym bardzo uderzającym przykładem modyfikacji post -translacyjnych, które mają związek z proteolitycznym Clivaje, jest niektóre hormony i enzymy z aktywnością proteazy, które są syntetyzowane jako nieaktywne białka, które wymagają proteolitycznego usunięcia niektórych ich aminokwasów, aby stać się ich aktywnymi postaciami.
Sprzężone białka
Chociaż nie zawsze są one rozpoznawane jako takie, innymi bardzo ważnymi modyfikacjami translacyjnymi są te, które obejmują tworzenie białek, których struktura składa się z jednego lub więcej łańcuchów peptydowych związanych z związkiem niezwiązanym z białkiem, albo poprzez kowalencyjne wiązania lub słabsze interakcje i interakcje i interakcje i słabsze interakcje i interakcje przejściowy.
Zasadniczo białka te są klasyfikowane zgodnie z tożsamością frakcji nie -białko i wymagają takich części do wykonywania ich funkcji.
Może ci służyć: agar krwiTe frakcje lub porcje są znane jako Grupy protetyczne A dobrym przykładem tych białek jest hemoglobina, która jest połączona z grupą hemo.
Retikulum endoplazmatyczne w akcji
Wiele modyfikacji po translacyjnych rozpoczyna się w szorstkim retikulum endoplazmatycznym, w którym powiązane rybosomy tłumaczą białka, gdy są one wstawiane do błony tej organelli.
W retikulum endoplazmatycznym wiele białek nabywa ich ostateczną konformację strukturalną: ich sekwencje sygnalizacyjne są usuwane, składane w odpowiednich postaci, powstają mosty disiulfurowe, dodaje się grupy słodkie itp.
Rodzaje modyfikacji post -translacyjnych
W komórkach eukariotycznych opisano ponad 500 rodzajów różnych modyfikacji translacyjnych; Poniższa lista grupuje niektóre z najczęściej badanych:
-
Fosforylacja
Przeniesienie jednej lub większej liczby grup fosforanowych z cząsteczek o wysokiej energii, takich jak ATP, w kierunku grupy hydroksylowej aminokwasowej, takiej jak seryna, treonina i tyrozyna; Pośredniczą enzymy grupy Białka mężczyzn (Te fosforany są usuwane przez enzymy fosfatazy).
Jest to ważne w wielu zdarzeniach komórkowych, takich jak podział, transdukcja sygnału, metabolizm węglowodanów, wzrost komórek i postęp cyklu komórkowego, między innymi.
-
Sulfonowanie
Jest to dodanie grupy -So3H (sulfonowej) wyłącznie w marnotrawstwie aminokwasu tyrozynowego i jest typowe dla białek transmembraalnych lub białek, które są wydalane. Jest katalizowany przez enzymy tyrozilu-sulfotransferazy.
Jest to ważny proces funkcjonowania wielu receptorów błonowych dla niektórych rodzajów oznakowania wewnątrzkomórkowego itp.
-
Powstawanie mostu disulfurowego między cysteinami
Proces ten występuje między resztami cysteiny i jest jedną z najważniejszych modyfikacji translacyjnych z strukturalnego punktu widzenia. Mosty disiarczkowe są ustalane w organellach, takich jak kompleks Golgiego i retikulum endoplazmatyczne, które mają środowiska utleniające.
Ta post -translacyjna modyfikacja dotyczy ustanowienia pewnej konfiguracji strukturalnej, która jest zwykle bardzo ważna dla aktywności licznych enzymów.
-
Metylacja
Polega na dodaniu grup metylowych w aminokwasach, takich jak lizyna, arginina, histydyna, glutamina i asparagina (N-metylacja), takich jak asparagan i glutaminian (O-metylacja) lub jako cysteina (S-metylacja).
Występuje dzięki katalitycznym działaniu enzymów znanych jako N-, O lub S-metylotransferazy. Metylacja białka jest niezbędna do regulacji transkrypcji genetycznej na poziomie białka histonowego, ale również odgrywa niższą rolę w transdukcji sygnału.
-
Acetylacja
Implikuje dodanie grup acetylowych do reszt lizyny niektórych białek. Jest katalizowany przez enzymy acetylotransferazy, a także ma bardzo ważne funkcje z punktu widzenia regulacji ekspresji genetycznej (na poziomie białek histonowych, które wiążą się z DNA).
-
Hydroksylacja
Zwykle występuje w odpadach proliny, lizyny i asparaginy i jest katalizowany przez enzymy hydroksylazy zależne od żelaza. Powstałe aminokwasy, hydroksyprol i hydroksylisin są bardzo ważne dla dojrzewania niektórych białek (w tym kolagenu) oraz dla niektórych związków antybiotykowych i przeciwgrzybiczych (hydroksyasparagina).
-
Glikozylacja
Ta modyfikacja jest bardzo ważnym procesem dla komórek eukariotycznych. Występuje przede wszystkim na odpadach serynowych i szparaginowych, ale może również wystąpić na hydroksyprolinach lub hydroksylisinach.
Może ci służyć: ewolucjonizm: pochodzenie, darwin, ewolucja społeczna, liniowa i kulturowaSkłada się z dodania cząsteczek węglowodanów do struktury białka i jest katalizowany przez enzymy glikozylotransferazy i występuje szczególnie w białkach wydalania oraz w tych stwierdzonych na powierzchni komórki.
-
Prenyla
Składa się z przeniesienia grup isaprenilos (lipid) do niektórych białek. Enzymy odpowiedzialne są specyficznymi transfrazami dla każdej grupy.
Proces ten jest ważny dla zakotwiczenia niektórych białka w błonach komórkowych, ale występuje również podczas transdukcji sygnału itp.
-
Wszechobecność
Jest to kowalencyjne dodanie jednego lub kilku kopii peptydu znanego jako Ubikwityna. Ten dodatek marka Do białek do degradacji w kompleksie białkowym znanym jako proteosom 26S.
Reprezentuje bardzo wydajny system regulacji wewnątrzkomórkowej i jest odpowiedzialny za niszczenie białek za pomocą trasy zależnej od ATP i uczestnictwem trzech różnych enzymów nazywanych E1, E2 i E3.
Przykłady
Fosforylacja i glyslacja to dwie niezwykle ważne modyfikacje po translacyjnej dla życia komórkowego. Nie tylko dlatego, że kontrolują wiele procesów związanych z komunikacją i cyklem komórkowym, ale także dlatego, że są one bardzo powszechne wśród eukariotów.
Na przykład białko p53 jest białkiem znanym jako „supresor nowotworów”, które jest stosowane podczas niektórych leczenia raka. Jego aktywacja zależy od działania różnych białek kinazy, które są odpowiedzialne za fosforylację jego N-końcowego końca.
Z drugiej strony powierzchnia komórek eukariotycznych zawiera dużą liczbę glikoprotein (białka zmodyfikowane po translacyjnym przez dodanie węglowodanów).
Wiele z tych białek ma ważne funkcje rozpoznawania odporności, w migracji komórek, w rozpoznawaniu i związku z receptorami, między innymi.
Bibliografia
- Alberts, ur., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… I Walter, P. (2015). Niezbędna biologia komórki. Garland Science.
- Cox, m. M., & Nelson, D. L. (2008). Zasady biochemii lehninger. Wh Freeman.
- Garrett, r. H., I Grisham, C. M. (1999). Biochemia.
- Green, k. D., & Garneau-Tesodikova, s. (2010). Postranslacyjna modyfikacja białek.
- Walsh, c. T., Garneau - -Sodikova, s., & Gatto Jr, G. J. (2005). Post -translacyjne modyfikacje białka: chemia dywersyfikacji proteomów. Angewandte Chemie International Edition, 44 (45), 7342-7372.