Model mechaniczny kwantowy atomu

- 2842
- 530
- Pani Gilbert Stolarczyk
Jaki jest kwantowy model mechaniczny atomu?
On Model mechaniczny kwantowy atomu Przypuszcza, że jest to tworzone przez centralne jądro utworzone przez protony i neutrony. Elektrony o obciążeniu ujemnym, owijają jądro w rozproszone regiony znane jako orbitale.
Kształt i rozszerzenie orbitali elektronicznych jest określone przez kilka wielkości: potencjał rdzenia i kwantyzowane poziomy energii i pędu kątowe elektronów.
 Rysunek 1. Model atomu helu zgodnie z mechaniką kwantową. Składa się z chmury prawdopodobieństwa dwóch elektronów helu, które otaczają jądro dodatnie 100 tysięcy razy mniejsze. Źródło: Wikimedia Commons.
Rysunek 1. Model atomu helu zgodnie z mechaniką kwantową. Składa się z chmury prawdopodobieństwa dwóch elektronów helu, które otaczają jądro dodatnie 100 tysięcy razy mniejsze. Źródło: Wikimedia Commons. Według mechaniki kwantowej elektrony mają zachowanie podwójnego cząstka fali, a skala atomowa są rozproszone i niespecyficzne. Wymiary atomu są praktycznie określone przez rozszerzenie orbitali elektronicznych otaczających jądro dodatnie.
Rycina 1 pokazuje strukturę atomu helu, który ma jądro z dwoma protonami i dwoma neutronami. To jądro jest otoczone chmurą prawdopodobieństwa dwóch elektronów otaczających jądro, które jest sto tysięcy razy mniejsze. Na poniższym obrazie widać atom helu, z protonami i neutronami w jądrze i elektron w orbitalach.

Rozmiar atomu helu jest rzędu Angstrom (1 Å), czyli 1 x 10^-10 m. Podczas gdy wielkość jego jądra jest rzędu femtometr (1 fm), czyli 1 x 10^-15 m.
Pomimo tego, że jest tak małe, 99,9% masy atomowej jest zatężone w małym jądrze. Wynika to z faktu, że protony i neutrony są 2000 razy cięższe niż otaczające je elektrony.
Może ci służyć: 31 rodzajów siły w fizyce i ich cechySkala atomowa i zachowanie kwantowe
Jedną z koncepcji, które miały największy wpływ na rozwój modelu atomowego, był dualność Fala - cząstka: Odkrycie, że każdy obiekt materialny ma fala materii.
Formuła, która umożliwia obliczenie długości fali λ Louis de Broglie, powiązany z obiektem materialnym w 1924 roku i jest następujący:
λ = h / (m v)
Gdzie H To jest stała Plancka, M ciasto i v prędkość.
Zgodnie z zasadą de Brogliego każdy obiekt ma podwójne zachowanie, ale w zależności od skali interakcji, prędkości i masy zachowanie fali może być bardziej znane niż cząsteczka lub odwrotnie.
Elektron jest światłem, jego masa wynosi 9,1 × 10^-31 kg. Typowa prędkość elektronu wynosi 6000 km/s (pięćdziesiąt razy mniej niż prędkość światła). Ta prędkość odpowiada wartościom energii w zakresie dziesiątek elektron-woltio.
Z poprzednimi danymi i przy użyciu wzoru de Broglie można uzyskać długość fali elektronów:
λ = 6,6 x 10^-34 J S / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektron do typowych energii poziomów atomowych ma długość fali o tym samym rzędu wielkości, co skala atomowa, tak że w tej skali ma on ondulatory.
Pierwsze modele kwantowe
Mając na uwadze pomysł, że elektron skali atomowej ma pofalowane zachowanie, opracowano pierwsze modele atomowe oparte na zasadach kwantowych. Wśród nich wyróżnia się model atomowy Bohra, który doskonale przewidział spektrum emisji wodoru, ale nie z innych atomów.
Może ci służyć: wysiłek napięcia: wzór i równania, obliczenia, ćwiczeniaModel Bohra, a następnie model Sommerfeld, były modelem półklasycznym. Oznacza to, że elektron był jako cząstka poddana elektrostatycznej sile przyciągania jądra, która orbituje wokół niego, rządzona drugim prawem Newtona.
Dodatkowo do klasycznych orbit, te pierwsze modele uwzględniły, że elektron miał powiązaną falę materiałową. Dozwolone były tylko orbity, których obwód był liczbą całkowitą długości fali, ponieważ te, które nie spełniają tego kryterium, zniknęły przez niszczycielskie zakłócenia.
Zatem kwantyzacja energii w strukturze atomowej pojawia się po raz pierwszy.
Słowo kwant dokładnie wynika z faktu, że elektron może przyjmować tylko pewne dyskretne wartości energii w atomie. Zbiega się to ze odkryciem Plancka, które polegało na odkryciu, że promieniowanie częstotliwości F Oddziaływać z materią w pakietach energii E = H F, Gdzie H To jest stała Plancka.
Kształt i rozmiar orbitalny
Zakres promieniowy orbity jest określany przez Funkcja fali radiowejdo. Jest większy w zakresie, w jakim energia elektronu rośnie, to znaczy w zakresie, w jakim wzrasta główna liczba kwantowa.
Odległość promieniowa jest zwykle mierzona w radiotelefonach BOHR, które dla najniższej energii wodoru wynosi 5,3 x 10-11 m = 0,53 Å.
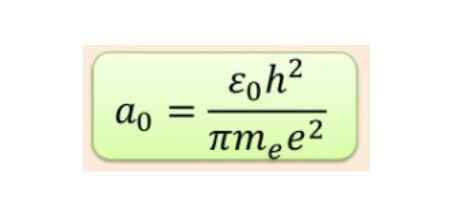 Rysunek 2. Formuła promienia Bohr. Źródło: f. Zapata.
Rysunek 2. Formuła promienia Bohr. Źródło: f. Zapata. Ale forma orbitali zależy od wartości kwantowej liczby pędu kątowego. Jeśli l = 0 masz sferyczny orbital zwany s, jeśli l = 1 masz zadzwoni orbital z pułapką P, które mogą mieć trzy orientacje zgodnie z magnetyczną liczbą kwantową. Poniższy rysunek pokazuje formę orbitali.
Może ci służyć: wielkość wektora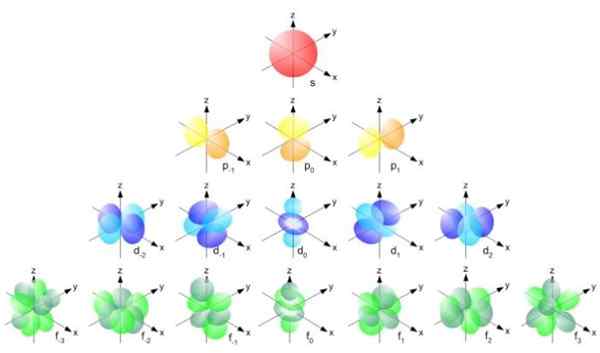 Rysunek 3. Forma orbitali S, P, D, F. Źródło: Ucdavis chemwiki.
Rysunek 3. Forma orbitali S, P, D, F. Źródło: Ucdavis chemwiki. Te orbitale są pakowane w innych zgodnie z energią elektronów. Na przykład poniższy rysunek pokazuje orbitale w atomie sodu.
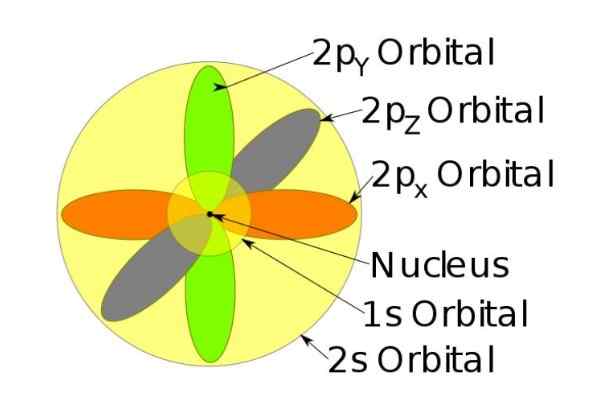 Rysunek 4. Orbitale 1s, 2s, 2p jonu sodu, gdy stracił elektron. Źródło: Wikimedia Commons.
Rysunek 4. Orbitale 1s, 2s, 2p jonu sodu, gdy stracił elektron. Źródło: Wikimedia Commons. Spin
Kwantowy model mechaniczny równania Schrödingera nie zawiera spinu elektronowego. Ale Pauli jest brany pod uwagę za pomocą zasady wykluczenia, która wskazuje, że orbitale mogą wypełnić do dwóch elektronów z kwantowymi liczbami spinowymi s = +½ i s = -½.
Na przykład jon sodu ma 10 elektronów, to znaczy, jeśli odnosimy się do poprzedniej liczby, istnieją dwa elektrony dla każdego orbity.
Ale jeśli jest to neutralny atom sodu, istnieje 11 elektronów, z których ostatnia zajmowałaby orbital 3S (nie pokazany na rysunku i o większym promieniu niż 2s). Spin atomu jest decydujący w cechach magnetycznych substancji.
Bibliografia
- Alonso - Finn. Fundamenty kwantowe i statystyczne. Addison Wesley.
- Eisberg - Resnick. Fizyka kwantowa. Limusa - Wiley.
- Gasiorowicz. Fizyka kwantowa. John Wiley & Sons.
- HSC. Kurs fizyki 2. Jacaranda Plus.
- Wikipedia. Model atomowy Schrodingera. Odzyskane z: Wikipedia.com

