Charakterystyka modelu atomowego Thomsona, postuluje, cząstki subatomowe
- 817
- 224
- Paweł Malinowski
On Model atomowy Thomsona Został stworzony przez angielskiego fizycznego słynnego j. J. Thomson, który odkrył elektron. Z powodu tego odkrycia i jego dzieł na temat przewodnictwa elektrycznego w gazach, został nagrodzony w 1906 r. Nagrodą Nobla w dziedzinie fizyki.
Z pracy z promieniami katodowymi ujawniono, że atom nie był niepodzielnym bytem, jak Dalton postulował w poprzednim modelu, ale zawierał dobrze zdefiniowaną strukturę wewnętrzną.

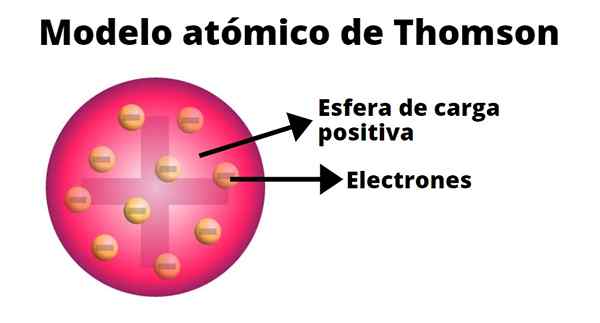
Thomson opracował model atomu oparty na wynikach swoich eksperymentów z promieniami katodowymi. W nim potwierdził, że atom, neutralny elektrycznie, powstał z dodatnich i ujemnych ładunków o równej wielkości.
[TOC]
Jak nazywał się model atomowy Thomsona i dlaczego?
Według Thomsona obciążenie dodatnie rozłożono w całym atomie, a ładunki ujemne zostały w nim osadzone, jakby były rodzynkami budynia. Z tego porównania pojawił się termin „pudding rodzynkowy”, ponieważ model był nieformalnie znany.
 Joseph John Thomson
Joseph John Thomson Podczas gdy pomysł Thomsona jest obecnie dość prymitywny, za jego czas reprezentował nowatorski wkład. Podczas krótkiej ważności modelu (w latach 1904–1910) miał poparcie wielu naukowców, chociaż wielu innych uważało to za herezję.
Wreszcie w 1910 r. Pojawiły się nowe dowody na temat struktury atomowej, a model Thomsona szybko pozostał na bok. Stało się tak, gdy Rutherford opublikował wyniki swoich eksperymentów z dyspersją, które wykazały istnienie jądra atomowego.
Jednak model Thomsona był pierwszym, który postulował istnienie cząstek subatomowych, a ich wyniki były owocem drobnych i rygorystycznych eksperymentów. W ten sposób ustalił precedens dla wszystkich następujących odkryć.
Charakterystyka i postulaty modelu Thomsona
Thomson dotarł do swojego modelu atomowego na podstawie kilku obserwacji. Pierwsze było to, że nowo odkryte przez Roentgen były w stanie jonizować cząsteczki powietrza. Do tego czasu jedynym sposobem na jonizację było chemiczne oddzielanie jonów na roztwór.
Ale angielski fizyk z powodzeniem jonizuje nawet gazy monoatomiczne, takie jak hel, przez x -kas. Doprowadziło go to do przekonania, że obciążenie w atomie można rozdzielić, a zatem nie było to niepodzielne.Zauważył również, że promienie katodowe mogą być kierowane przez pól elektryczna i magnetyczna.
 J.J. Thomson, odkrywca elektronu. Źródło: Lafer.
J.J. Thomson, odkrywca elektronu. Źródło: Lafer. Następnie Thomson opracował model, który poprawnie wyjaśnił fakt, że atom jest neutralny elektrycznie i że promienie katodowe składają się z cząstek o obciążeniu ujemnym.
Przeglądając dowody eksperymentalne, Thomson scharakteryzował atom w następujący sposób:
-Atom jest elektrycznie neutralną kulą stałą, o przybliżonym promieniu 10-10 M.
-Obciążenie dodatnie jest rozmieszczone mniej lub bardziej równomiernie przez kulę.
-Atom zawiera negatywnie „ciśnienia”, które zapewniają ich neutralność.
-Te ciałki są takie same dla wszystkich.
-Kiedy atom jest w równowadze, istnieje N Corguss regularnie ułożone w pierścienie w sferze obciążenia dodatnim.
-Masa atomu jest równomiernie rozłożona.
Promienie katodowe
 Wiązka elektronów jest skierowana z katody do anody.
Wiązka elektronów jest skierowana z katody do anody. Thomson przeprowadził swoje eksperymenty za pomocą promieni katodowych, odkryte w 1859 roku. Promienie katodowe to ujemnie naładowane cząstki. Aby je wytworzyć, stosuje się rurki kryształowe próżniowe, w których nazywane są dwie elektrody katoda I anoda.
Może ci służyć: magnetyzm: właściwości magnetyczne materiałów, zastosowaniaNastępnie przepuszcza się prąd elektryczny, który ogrzewa katodę, która w ten sposób emituje niewidoczne promieniowanie, które jest skierowane bezpośrednio do przeciwnej elektrody.
Aby wykryć promieniowanie, które jest niczym innym niż promieniami katodowymi, ściana rurkowa jest pokryta materiałem fluorescencyjnym. Kiedy pojawia się promieniowanie, ściana rurowa wydziela intensywną jasność.
Jeśli na ścieżce promieni katodowych jest wtykany stałym obiektem, rzuca cień na ścianę rurową. Wskazuje to, że promienie podróżują w linii prostej, a także mogą je łatwo zablokować.
Charakter promieni katodowych był szeroko omawiany, ponieważ jego natura była nieznana. Niektórzy myśleli, że są fale elektromagnetycznymi, podczas gdy inni argumentowali, że są cząstkami.
Cząstki subatomowe Model atomowy Thomsona
Model atomowy Thomsona jest, jak powiedzieliśmy, pierwszy postulował istnienie cząstek subatomowych. Korpusy Thomsona są niczym innym jak elektrony, podstawowe cząstki negatywnie obciążonego atomu.
Obecnie wiemy, że pozostałe dwie podstawowe cząstki to proton, dodatnio załadowany, a neutron bez obciążenia.
Ale nie zostały one odkryte w tym czasie, że Thomson opracował swój model. Pozytywny ładunek w atomie został w nim rozmieszczony, nie wziął pod uwagę żadnych cząstek niosących wspomniane obciążenie, a w tej chwili nie było dowodów na jego istnienie.
Z tego powodu jego model miał przelotne istnienie, ponieważ w ciągu kilku lat eksperymenty z rozproszeniem Rutherforda otworzyły drogę do odkrycia protonu. A co do neutronów, sam Rutherford zaproponował swoje istnienie na kilka lat przed ostatecznym odkryciem.
Rurka Crookesa
Sir William Crookes (1832–1919) zaprojektował rurkę, która nosi jego imię około 1870. Dodał pola elektryczne i pola magnetyczne i zauważył, że promienie zostały przez nich przekierowane.
 Schemat rurki Ray Cathod. Źródło: Knight, r.
Schemat rurki Ray Cathod. Źródło: Knight, r. W ten sposób oszustowie i inni badacze, w tym Thomson, stwierdzili, że:
- Wewnątrz rurki Ray Cathode wytwarzono prąd elektryczny
- Promienie były odchylone przez obecność pól magnetycznych, w taki sam sposób, jak ujemnie naładowane cząstki.
- Każdy metal używany do produkcji katody był równie dobrze do produkcji promieni katodowych, a ich zachowanie było niezależne od materiału.
Te obserwacje podsyciły dyskusję wokół pochodzenia promieni katodowych. Ci, którzy argumentowali, że były to fale, opierali się na fakcie, że promienie katody mogły podróżować w linii prostej. Ponadto, ta hipoteza bardzo dobrze wyjaśniła cień, że interpowany stały obiekt rzucił na ścianę rurki i pod pewnymi okolicznościami wiadomo było, że fale mogą powodować fluorescencję.
Ale zamiast tego nie zrozumiało, jak to możliwe, że pola magnetyczne odwróciły promienie katodowe. To miało wyjaśnienie tylko wtedy, gdy promienie te zostały uznane za cząstki, hipotezę, którą podzielił Thomson.
Cząstki załadowane jednolitym pola elektrycznym i magnetycznym
Cząstka obciążenia Q, doświadcza siły wiary pośrodku jednolitego pola elektrycznego i, wielkości:
Może ci służyć: pofalowana teoria światła: wyjaśnienie, aplikacje, przykładyFaith = QE
Gdy obciążona cząstka prostopadle przechodzi jednolite pole elektryczne, takie jak ta, która występuje między dwoma płytkami o przeciwnych obciążeniach, doświadcza odchylenia, a zatem przyspieszenie:
QE = Ma
a = qe/m
Z drugiej strony, jeśli obciążona cząstka porusza się z prędkością wielkości V, pośrodku jednolitego pola magnetycznego o wielkości B, siła magnetyczna FM, która doświadcza, ma następującą intensywność:
FM = QVB
Tak długo, jak prędkość i wektory pola magnetyczne są prostopadłe. Gdy obciążona cząsteczka wpływa prostopadle w jednorodnym polu magnetycznym, doświadcza również odchylenia, a jego ruch jest jednolity okrągły.
Przyspieszenie dośrodkowe doC W takim przypadku jest to:
QVB = MAC
Z kolei przyspieszenie dośrodkowe jest związane z prędkością cząstki V i promieniem r trajektorii okrągłej:
DoC = v2/R
Dlatego:
Qvb = mv2/R
Promień trajektorii kołowej można obliczyć w następujący sposób:
R = mv/qb
Później równania te zostaną wykorzystane do odtworzenia sposobu, w jaki Thomson wydedukował stosunek obciążenia elektronów.
Eksperyment Thomsona
Thomson minął wiązkę promieni katodowych, wiązkę elektronów, chociaż nadal nie wiedział, przez jednolite pola elektryczne. Te pola są tworzone między dwoma przewodzącymi płytkami załadowanymi i oddzielonymi w niewielkiej odległości.
Promienie katodowe również przeszły przez jednolite pole magnetyczne, obserwując efekt, jaki miało to na wiązkę. Zarówno w jednym polu, jak i drugie, w promieniach nastąpiło ugięcie, co skłoniło Thomsona do myślenia, że wiązka składała się z naładowanych cząstek.
Aby sprawdzić, Thomson przeprowadził kilka strategii z promieniami katodowymi:
- Zmieniaj pól elektryczną i magnetyczną, aż siły nie zostały odwołane. W ten sposób promienie katodowe przechodzą bez eksperymentowania ugięcia. Dopasowując siły elektryczne i magnetyczne, Thomsonowi udało się określić prędkość cząstek wiązki.
- Unieważnił intensywność pola elektrycznego, w ten sposób cząstki podążały za okrągłym trajektorią na środku pola magnetycznego.
- Połączył wyniki kroków 1 i 2 w celu ustalenia stosunku obciążenia „korpusów”.
Stosunek ładunku elektronowego
Thomson ustalił, że stosunek ładunku cząstek, które stanowią wiązkę promieni katodowych, ma następującą wartość:
Q/m = 1.758820 x 10 11 C.KG-1.
Gdzie Q reprezentuje obciążenie „korpusu”, który jest w rzeczywistości elektronem i M Jest to masa tego samego. Thomson postępował zgodnie z procedurą opisaną w poprzedniej sekcji, którą odtwarzamy tutaj krok po kroku, z zastosowanymi równaniami.
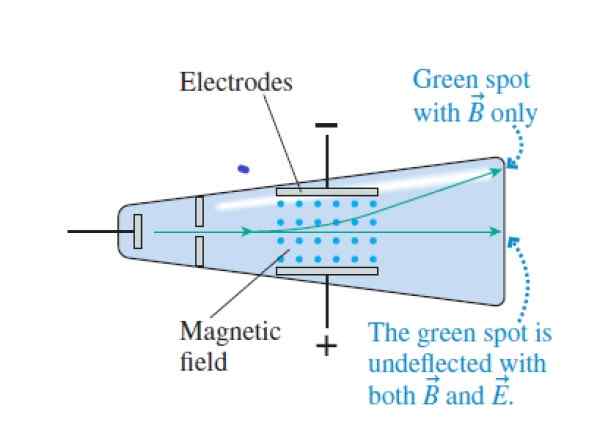 Kiedy promienie katody krzyżują się przez krzyżowe i magnetyczne pola, przechodzą bez ugięcia. Po anulowaniu pole elektryczne wpływają na górną część rurki (pole magnetyczne jest wskazane niebieskimi punktami między elektrodami). Źródło: Knight, r.
Kiedy promienie katody krzyżują się przez krzyżowe i magnetyczne pola, przechodzą bez ugięcia. Po anulowaniu pole elektryczne wpływają na górną część rurki (pole magnetyczne jest wskazane niebieskimi punktami między elektrodami). Źródło: Knight, r. Krok 1
Dopasuj siłę elektryczną i siłę magnetyczną, przechodząc przez wiązkę przez prostopadłe pola elektryczne i magnetyczne:
Qvb = qe
Krok 2
Określ prędkość uzyskaną przez cząstki wiązki, gdy przechodzą bezpośrednio bez ugięcia:
V = e/b
Krok 3
Anuluj pole elektryczne, pozostawiając tylko pole magnetyczne (teraz jest ugięcie):
R = mv/qb
Z wynikami V = E/B:
R = Me/QB2
Dlatego promień orbity można zmierzyć:
Q/m = v/rb
O Cóż:
Q/m = e/rb2
Następne kroki
Następną rzeczą, którą zrobił Thomson, było zmierzenie ilorazu Q/m za pomocą katod wykonanych z różnych materiałów. Jak wspomniano powyżej, wszystkie metale emitowały promienie katodowe o identycznych cechach.
Może ci służyć: reaktancja indukcyjnaNastępnie Thomson porównał swoje wartości z wartościami stosunku Q/M jonu wodoru, uzyskanego przez elektrolizę i którego wartość wynosi około 1 x 108 C/kg. Elektronowy iloraz obciążenia jest około 1750 razy większy niż jon wodoru.
Dlatego promienie katodowe miały znacznie większe obciążenie, a może masę znacznie mniejszą niż jon wodoru. Jon wodoru jest po prostu protonem, którego istnienie było znane czas po eksperymentach rozproszenia Rutherforda.
Dziś wiadomo, że proton jest prawie 1800 razy bardziej masywny niż elektron i z obciążeniem równej wielkości i znaku sprzecznego z elektronem.
Kolejnym ważnym szczegółem jest to, że w przypadku eksperymentów Thomsona ładunek elektronowy nie został ustalony, ani wartość jego masy osobno. Wartości te zostały określone przez eksperymenty Millikana, które rozpoczęły się w 1906 roku.
Thomson i Dalton modelują różnice
Podstawową różnicą tych dwóch modeli polega na tym, że Dalton myślał, że atom jest kulą. W przeciwieństwie do Thomsona, nie zaproponował istnienia ładunków pozytywnych lub negatywnych. Dla Daltona atom był taki:
 Dalton Atom
Dalton Atom Jak widzieliśmy wcześniej, Thomson pomyślał, że atom jest podzielny i którego struktura jest tworzona przez dodatnią kulę i elektrony.
Modelowe awarie i ograniczenia
W tym czasie model atomowy Thomsona udało się bardzo dobrze wyjaśnić zachowanie chemiczne substancji. Słusznie wyjaśnił również zjawiska, które miały miejsce w rurce Ray Cathode.
Ale w rzeczywistości Thomson nawet nie nazwał swoich cząstek „elektronów”, chociaż termin ten był już wymyślony przez George'a Johnstone Stoney. Thomson po prostu nazwał je „ciałkami”.
Chociaż Thomson wykorzystał całą wiedzę, jaką miał na chwilę, istnieje kilka ważnych ograniczeń w jego modelu, które wkrótce były widoczne:
-Obciążenie dodatnie nie jest rozmieszczone w całym atomie. Eksperymenty z dyspersją Rutherforda wykazały, że dodatnie obciążenie atomu jest koniecznie ograniczone do jego małego regionu, który później stał się znany jako jądro atomowe.
-Elektrony mają określony rozkład w obrębie każdego atomu. Elektrony nie są równomiernie rozmieszczone, takie jak rodzynki słynnego Buddina, ale mają usposobienie w orbitalach, które pokazały kolejne modele.
Właśnie rozmieszczenie elektronów w atomie pozwala na organizację elementów dla ich cech i właściwości w tabeli okresowej. To było ważne ograniczenie modelu Thomsona, które nie mogło wyjaśnić, w jaki sposób można zamówić elementy w ten sposób.
-Jądro atomowe jest tym, które zawiera większość ciasta. Model Thomsona postulował, że masa atomu była równomiernie rozłożona w środku. Ale dzisiaj wiemy, że masa atomu jest praktycznie skoncentrowana w protonach i neutronach jądra.
Ważne jest również, aby podkreślić, że ten model atomu nie pozwolił na wnioskowanie o rodzaju ruchu, jaki elektrony miały w atomie.
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Dalton.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Leucipo.
Model atomowy Bohr.
Model atomowy Sommerfeld.
Obecny model atomowy.
Bibliografia
- Andriessen, m. 2001. Kurs HSC. Fizyka 2. Jacaranda HSC Science.
- Arfken, g. 1984. Fizyka uniwersytecka. Academic Press.
- Knight, r. 2017. Fizyka dla naukowców i inżynierii: podejście strategiczne. osoba.
- Rex, a. 2011. Podstawy fizyki. osoba.
- Wikipedia. Model atomowy Thomsona. Odzyskane: to jest.Wikipedia.org.
- « Ogólne równania kwadratowe, przykłady, ćwiczenia
- Model Aomic o cechach i postulatach Dirac Jordan »

