Model atomowy Schrödingera

- 2149
- 340
- Estera Wojtkowiak
Jaki jest model atomowy Schrödingera?
On Model atomowy Schrödingera Jest to propozycja działania i struktury atomu opracowanego przez Erwina Schrödingera w 1926 roku. Jest znany jako kwantowy model mechaniczny atomu i opisuje zachowanie falowe elektronu.
W tym celu wybitny austriacki fizyk oparto na hipotezie Broglie, który stwierdził, że każda poruszająca się cząstka jest związana z falą i może zachować się jako taką.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger zasugerował, że ruch elektronów w atomie odpowiadał dualizacji fali cząstkowej, w związku z czym elektrony mogą zmobilizować wokół jądra jako fale stacjonarne.
Schrödinger, który otrzymał Nagrodę Nobla w 1933 r. Za swój wkład w teorię atomową, opracował równanie homonimiczne w celu obliczenia prawdopodobieństwa, że elektron będzie w określonej pozycji.
Charakterystyka modelu atomowego Schrödingera
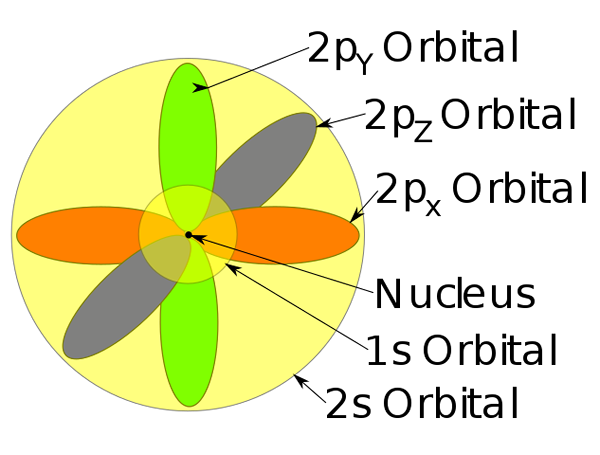 Orbitale 1s, 2s i 2p wewnątrz atomu sodu.
Orbitale 1s, 2s i 2p wewnątrz atomu sodu. -Ten model atomu opisuje ruch elektronów jako fale stacjonarne.
-Elektrony poruszają się stale, to znaczy nie mają ustalonej ani określonej pozycji w atomie.
-Ten model nie przewiduje lokalizacji elektronów, ani nie opisuje trasy, którą wykonuje w Atomie. Ustanawia tylko strefę prawdopodobieństwa zlokalizowania elektronu.
-Te obszary prawdopodobieństwa nazywane są orbitalem atomowym. Orbitale opisują ruch tłumaczenia wokół jądra atomu.
-Te orbitale atomowe mają różne poziomy i poziomy energii i można je zdefiniować między chmurami elektronów.
-Model nie rozważa stabilności jądra, odnosi się tylko do wyjaśnienia mechaniki kwantowej związanej z ruchem elektronów w Atomie.
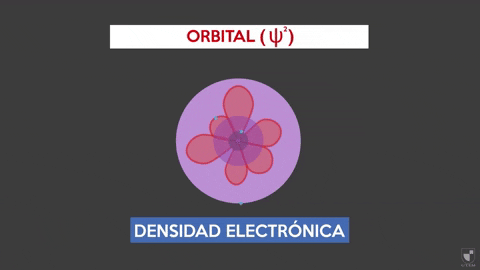 Gęstość elektroniczna wskazuje na prawdopodobieństwo znalezienia elektronu w pobliżu jądra. Im bliżej jądra (strefy fioletowej) będzie większe prawdopodobieństwo, podczas gdy będzie mniejsze, jeśli odejdziesz od jądra (obszar fioletowy).
Gęstość elektroniczna wskazuje na prawdopodobieństwo znalezienia elektronu w pobliżu jądra. Im bliżej jądra (strefy fioletowej) będzie większe prawdopodobieństwo, podczas gdy będzie mniejsze, jeśli odejdziesz od jądra (obszar fioletowy). Eksperyment
Model atomowy Schrödingera opiera się na hipotezie Broglie, a także na poprzednich modelach atomowych Bohr i Sommerfeld.
Może ci służyć: tarcie dynamiczne lub kinetyczne: współczynnik, przykłady, ćwiczeniaBroglie zaproponował, że podobnie jak fale mają cząstki, cząstki mają właściwości falowe, mając powiązaną długość fali. Coś, co wywołało wówczas wiele oczekiwań, będąc samym Albertem Einsteinem w swojej teorii.
Jednak teoria Brogliego brakowała, że znaczenie własnego pomysłu nie było zbyt dobrze zrozumiane: elektron może być falą, ale co z czym z czym? Wtedy wydaje się, że postać Schrödingera odpowiada.
Aby to zrobić, austriacki fizyk polegał na eksperymencie Younga i na podstawie własnych obserwacji opracował matematyczne wyrażenie, które nosi jego imię.
Następnie naukowe podstawy tego modelu atomowego:
Eksperyment Younga: Pierwsza demonstracja dualności fali cząstkowej
Hipotezę Brogliego na temat pofałdowanego i ciałego charakteru przedmiotu można wykazać przez eksperyment Younga, znany również jako eksperyment podwójny.
Angielski naukowiec Thomas Young położył fundamenty modelu atomowego Schrödingera, gdy w 1801 r.
Podczas eksperymentów Young podzielił emisję wiązki światła, która przecina małą otwór przez komorę obserwacyjną. Podział ten osiąga się przy użyciu karty 0,2 milimetra, zlokalizowanej równolegle do wiązki.
Konstrukcja eksperymentu została wykonana, aby wiązka światła była szersza niż karta, umieszczając w ten sposób kartę w poziomie, wiązka podzielona na w przybliżeniu te same części. Wyjście wiązek światła zostało skierowane przez lustro.
Może ci służyć: siły odległościObie wiązki światła uderzają w ścianę w ciemnym pokoju. Tam wykazano wzór zakłóceń między dwiema falami, co pokazano, że światło może zachowywać się tak samo jak cząstka i fala.

Sto lat później Albert Einsten wzmocnił ten pomysł poprzez zasady mechaniki kwantowej.
Równanie Schrödingera
Schrödinger opracował dwa modele matematyczne, różnicując to, co dzieje się w zależności od tego, czy stan kwantowy zmienia się w czasie, czy nie.
Do analizy atomowej Schrödinger opublikował pod koniec 1926 roku.
Oznacza to, że fala nie porusza się, jej węzły, to znaczy jej punkty równowagi, służy jako obrotowy dla reszty konstrukcji, aby się ich poruszać, opisując określoną częstotliwość i amplitudę.
Schrödinger zdefiniował fale, które opisują elektrony jako stany stacjonarne lub orbitalne i są z kolei związane z różnymi poziomami energii.
Niezależne równanie czasowe Schrödingera jest następujące:
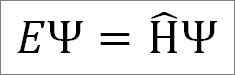
Gdzie:
I: Stała proporcjonalności.
Ψ: Funkcja fali systemowej kwantowej.
Η ̂: Hamiltonian Operator.
Niezależne równanie czasowe Schrödingera jest używane, gdy obserwowalne, które reprezentuje całkowitą energię systemu, znaną jako operator Hamiltonian, nie zależy od czasu. Jednak funkcja opisująca ruch całkowitego fali będzie zawsze zależeć od czasu.
Równanie Schrödingera wskazuje, że jeśli masz funkcję falową ψ, a operator Hamiltonian działa na nią, stała proporcjonalności i reprezentuje całkowitą energię układu kwantowego w jednym z jego stanów stacjonarnych.
Może ci służyć: zmienna dyskretna: cechy i przykładyZastosowany do modelu atomowego Schrödingera, jeśli elektron porusza się w określonej przestrzeni, istnieją dyskretne wartości energii, a jeśli elektron jest swobodnie przesunięty w przestrzeni, mają ciągłe przedziały energii.
Z matematycznego punktu widzenia istnieje kilka rozwiązań dla równania Schrödingera, każde rozwiązanie implikuje inną wartość dla stałej proporcjonalności i.
Zgodnie z zasadą niepewności Heisenberga nie można oszacować pozycji lub energii elektronów. W związku z tym naukowcy uznają, że oszacowanie lokalizacji elektronów w atomie jest niedokładne.
Postulaty modelu atomowego Schrödingera
Postulaty modelu atomowego Schrödingera są następujące:
-Elektrony zachowują się jak fale stacjonarne, które są rozmieszczone w przestrzeni zgodnie z funkcją falową ψ.
-Elektrony poruszają się wewnątrz atomu opisujące orbitale. Są to obszary, w których prawdopodobieństwo znalezienia elektronu jest znacznie wyższe. Wspomniane prawdopodobieństwo jest proporcjonalne do kwadratu funkcji fali ψ2.
Konfiguracja elektroniczna modelu atomowego Schrödinguer wyjaśnia okresowe właściwości atomów i powiązań.
Jednak model atomowy Schrödingera nie rozważa spinu elektronów i nie uwzględnia zmian szybkich elektronów z powodu efektów relatywistycznych z powodu efektów relatywistycznych.
Artykuły zainteresowane
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dalton.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Leucipo.
Model atomowy Bohr.
Model atomowy Sommerfeld.
Obecny model atomowy.
Bibliografia
- Kwantowy model mechaniczny atomu odzyskany: tak jest.Khan academy.org
- Równanie falowe Schrödingera (s.F.). Jaime i University. Castellón, Hiszpania. Odzyskane z: uji.Jest
- Nowoczesna teoria atomowa: modele. © Abcte. Odzyskane z: Abcte.org
- Atomowy mod Schrodingera.F.). Odzyskane z: Erwinschrodingerbiography.Webly.com
- Wikipedia, bezpłatna encyklopedia. Równanie Schrödingera. Odzyskane z: jest.Wikipedia.org
- Wikipedia, bezpłatna encyklopedia. Młody eksperyment. Odzyskane z: jest.Wikipedia.org

