Model atomowy Heisenberga
- 2677
- 322
- Gabriela Łuczak
Jaki jest model atomowy Heisenberga?
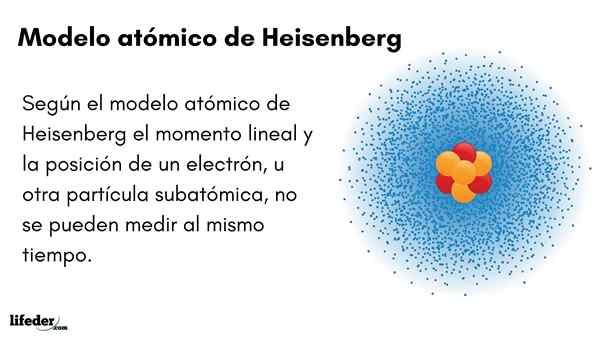
On Model atomowy Heisenberga (1927) wprowadza zasadę niepewności w orbitach elektronowych otaczających jądro atomowe. Wybitny niemiecki fizyk ustalił fundamenty mechaniki kwantowej w celu oszacowania zachowania cząstek subatomowych, które tworzą atom.
Zasada niepewności Wernera Heisenberga wskazuje, że z pewnością nie jest możliwe znanie pozycji liniowej elektronu. Ta sama zasada dotyczy zmiennych czasowych i energetycznych; To znaczy, jeśli mamy wskazanie na temat pozycji elektronu, zignorujemy liniowy moment elektronu i odwrotnie.
Krótko mówiąc, nie można jednocześnie przewidzieć wartości obu zmiennych. Powyższe nie oznacza, że żadnej z wcześniej wymienionych wielkości nie może być znana z precyzją. Ilekroć jest on osobno, nie ma przeszkód w uzyskaniu wartości odsetek.
Jednak niepewność ma miejsce, jeśli chodzi o jednocześnie znajomość dwóch sprzężonych wielkości, jak ma to miejsce w przypadku pozycji liniowej i momentu.
Zasada ta powstaje z powodu ściśle teoretycznego rozumowania, jako jedyne realne wyjaśnienie, aby dać rozum dotyczącej obserwacji naukowych.
Charakterystyka modelu atomowego Heisenberga
 Werner Heisenberg
Werner Heisenberg W marcu 1927 r. Heisenberg opublikował swoją pracę Na temat percepcyjnej zawartości filmów i mechaniki kwantowej, gdzie szczegółowo opisał zasadę niepewności lub nieokreśloności.
Ta zasada, fundamentalna w modelu atomowym zaproponowanym przez Heisenberga, charakteryzuje się następującymi:
- Zasada niepewności powstaje jako wyjaśnienie, które uzupełnia nowe teorie atomowe dotyczące zachowania elektronów. Pomimo zastosowania przyrządów pomiarowych o wysokiej precyzji i czułości, nieokreślność jest nadal obecna w każdym badaniu eksperymentalnym.
- Ze względu na zasadę niepewności, podczas analizy dwóch powiązanych zmiennych, jeśli masz dokładną wiedzę na temat jednego z nich, wówczas nieokreśloność na temat wartości drugiej zmiennej wzrośnie.
- Moment liniowy i położenie elektronu lub innej cząstki subatomowej nie mogą być mierzone jednocześnie.
- Związek między obiema zmiennymi jest dany przez nierówność. Według Heisenberga, iloczyn odmian momentu liniowego -3. 4 Jules x sekundy) i 4π, jak szczegółowo opisano w następującym wyrażeniu matematycznym:
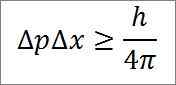
Legenda odpowiadająca temu wyrażeniu jest następująca:
∆P: nieokreślanie momentu liniowego.
∆X: Nieokreślone pozycję.
H: stała deska.
π: liczba PI 3.14.
- W związku z powyższym produkt niepewności ma niższy zatrzymanie relacji h/4π, co jest stałą wartością. Dlatego jeśli jedno z wielkości ma tendencję do zera, drugi musi wzrosnąć w tej samej proporcji.
- Ten związek jest ważny dla wszystkich par sprzężonych wielkości kanonicznych. Na przykład: Zasada niepewności Heisenberga ma doskonale zastosowanie do duetu czasowego energii, jak szczegółowo opisano:
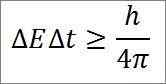
W tym wyrażeniu:
∆E: nieokreśloność energii.
∆T: nieokreślanie czasu.
H: stała deska.
π: liczba PI 3.14.
- Z tego modelu wynika, że bezwzględny determinizm przyczynowy w sprzężonych zmiennych kanonicznych jest niemożliwe, ponieważ aby ustalić ten związek, należy ustalić wiedzę o początkowych wartościach zmiennych badań.
- W związku z tym model Heisenberga opiera się na preparatach probabilistycznych, ze względu na losowość między zmiennymi do poziomów subatomowych.
Testy eksperymentalne
Zasada niepewności Heisenberga powstaje jako jedyne możliwe wyjaśnienie testów eksperymentalnych, które miały miejsce w ciągu pierwszych trzech dekad XXI wieku.
Zanim Heisenberg wydał zasadę niepewności, przykazania obowiązujące wówczas zasugerowały, że zmienne pędu liniowego, pęd kątowy, czas, energia, między innymi dla cząstek subatomowych, które zostały operatywnie zdefiniowane.
Oznaczało to, że byli traktowani tak, jakby były fizyką klasyczną; to znaczy zmierzono wartość początkową, a wartość końcową oszacowano zgodnie z wstępnie ustaloną procedurą.
Może ci służyć: wielkość wektoraPowyższe oznaczało zdefiniowanie systemu referencyjnego pomiarów, przyrządu pomiarowego i formy użycia wspomnianego instrumentu, zgodnie z metodą naukową.
Zgodnie z tym zmienne opisane przez cząstki subatomowe musiały zachowywać. Oznacza to, że jego zachowanie powinno być przewidywane dokładne i dokładnie.
Jednak za każdym razem, gdy wykonywano esej o tym charakterze, niemożliwe było uzyskanie teoretycznie szacowanej wartości.
Środki zostały wprowadzone w błąd ze względu na naturalne warunki eksperymentu, a uzyskany wynik nie był przydatny do wzbogacenia teorii atomowej.
Przykład
Na przykład: jeśli chodzi o pomiar prędkości i położenia elektronu, montaż eksperymentu musi rozważyć zderzenie fotonu światła z elektronem.
Ta zderzenie indukuje zmienność wewnętrznej prędkości i pozycji elektronu, tak że obiekt pomiaru jest zmieniany w warunkach eksperymentalnych.
Dlatego badacz zachęca do występowania nieuniknionego błędu eksperymentalnego, pomimo dokładności i precyzji używanych instrumentów.
Mechanika kwantowa inne niż mechanika klasyczna
Oprócz powyższego zasada nieokreśloności Heisenberga stwierdza, że z definicji mechanika kwantowa działa inaczej w odniesieniu do mechaniki klasycznej.
W związku z tym zakłada się, że dokładna znajomość miar subatomowych jest ograniczona cienką linią, która oddziela klasyczną i kwantową mechanikę.
Ograniczenia modelu Heisenberga
Pomimo wyjaśnienia nieokreśloności cząstek subatomowych i posiedzeniu różnic między mechaniką klasyczną i kwantową, model atomowy Heisenberga nie ustanawia unikalnego równania wyjaśniającego losowość tego rodzaju zjawisk.
Może ci służyć: energia grawitacyjna: formuły, cechy, zastosowania, ćwiczeniaPonadto fakt, że związek jest ustanowiony poprzez nierówność, oznacza, że zakres możliwości produktu dwóch sprzężonych zmiennych kanonicznych jest nieokreślony. W związku z tym niepewność związana z procesami subatomowymi jest znacząca.
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dalton.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Leucipo.
Model atomowy Bohr.
Model atomowy Sommerfeld.
Obecny model atomowy.
Bibliografia
- Beyler, r. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Odzyskane z: Britannica.com
- Zasada niepewności Heisenberga (s.F.). Odzyskane z: Hiru.EUS
- Garcia, J. (2012). Heisenberg Zasada niepewności. Odzyskane z: hiberus.com
- Modele atomowe (s.F.). National Autonomous University of Mexico. Miasto Meksyk, Meksyk. Odzyskany z: doradczy.Cuautitlan2.Unam.MX
- Werner Heisenberg (s.F.).Źródło: historia-off-atom.Wikispy.com
- Wikipedia, Free Encyclopedia (2018). Stała deska. Odzyskane z: jest.Wikipedia.org
- Wikipedia, Free Encyclopedia (2018). Heisenberg Relacje nieokreśloności. Odzyskane z: jest.Wikipedia.org

