Model atomowy Bohr

- 4431
- 887
- Filip Augustyn
On Model atomowy Bohr Jest to koncepcja duńskiego fizyka Nielsa Bohra (1885–1962) na temat struktury atomu, opublikowanego w 1913 roku. W atomie Bohr elektrony wokół jądra zajmują tylko pewne dozwolone orbity, dzięki ograniczeniu nazywanym kwantyzacja.
W przypadku Bohra, obraz atomu jako miniaturowego układu słonecznego, z elektronami poprzez krążenie wokół jądra, nie było to całkowicie zgodne z faktem, że ładunki elektryczne, gdy są one przyspieszone, promieniuj energią, promieniuj energią.

Taki atom nie byłby stabilny, ponieważ skończyłby się wcześniej lub później, ponieważ elektrony wytrącą spiralnie do jądra. I do tego czasu 50 lat temu charakterystyczne wzory światła, które emitują wodór i inne gazy podczas ogrzewania.
Wzór lub spektrum składa się z serii jasnych linii o niektórych bardzo specyficznych długościach fal. A atom wodoru nie zawala się, emitując światło.
Aby wyjaśnić, dlaczego atom jest stabilny, mimo że jest w stanie promieniować energią elektromagnetyczną, Bohr zaproponował, aby pęd kątowy mógł przyjąć tylko pewne wartości, a zatem energia również. To jest rozumiane przez kwantyzację.
Przyjmując, że energia została skwantyzowana, elektron miałby niezbędną stabilność, aby nie spieszyć się w kierunku jądra niszczącego atom.
A atom promieniuje energią światła tylko wtedy, gdy elektron przechodzi z jednej orbity na drugą, zawsze w dyskretnych ilościach. W ten sposób wyjaśniono obecność wzorców emisji w wodorze.
Bohr skomponowany w ten sposób wizja atomu integrująca znane pojęcia klasycznej mechaniki z nowo odkrytymi, takimi jak stała Plancka, foton, elektron, jądro atomowe (Rutherford był mentorem BOHR) i wyżej wspomnianymi widmami problemu.
[TOC]
Główne cechy modelu BOHR
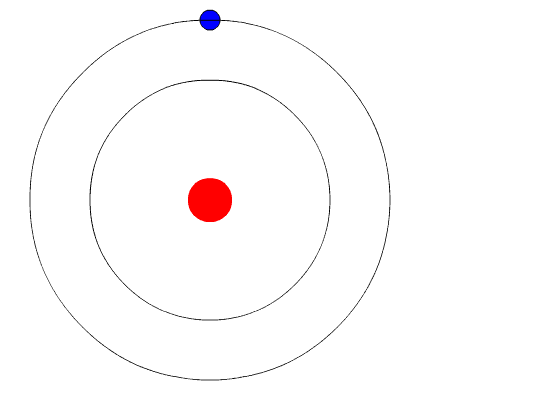 Atom Bohra. Animacja reprezentuje elektron, gdy przechodzi od wyższego poziomu energii do innego o mniejszej energii, emitując światło światła (foton). Źródło: Wikimedia Commons.
Atom Bohra. Animacja reprezentuje elektron, gdy przechodzi od wyższego poziomu energii do innego o mniejszej energii, emitując światło światła (foton). Źródło: Wikimedia Commons. Model atomowy Bohra zakłada, że elektron porusza się na okrągłej orbicie wokół rdzenia poprzez działanie elektrostatycznego przyciągania kulombowskiego i sugeruje, że pęd kątowy elektronu jest kwantyzowany.
Może ci służyć: wektor równoważenia: obliczenia, przykłady, ćwiczeniaZobaczmy, jak zintegrować oba koncepcje w formie matematycznej:
Niech l wielkość pędu kątowego, m masa elektronu i prędkość elektronu i r promień orbity. Aby obliczyć l, mamy:
L = M⋅R⋅V
Bohr zaproponował, że l był równy całościom wielokrotności stałej h/2π, gdzie h jest Planck stała, Wprowadzony niedawno przez fizyk Maxa Plancka (1858–1947) w rozwiązaniu problemu energetycznego emitowanego przez czarne ciało, obiekt teoretyczny, który pochłania całe światło padające.
Jego wartość to h = 6.626 × 10−34 J ・ s, podczas gdy w h/2π jest to oznaczone jako H, To czyta „H Bar”.
Dlatego pęd kątowy L pozostaje:
M⋅R⋅V = nH, Z n = 1,2, 3 ..
I z tego warunku wydedukowane są radiotelefony orbitów dozwolone dla elektronu, jak wtedy zobaczymy.
Obliczanie promienia orbity elektronów
W dalszej części założymy najprostsze atomy: wodór, który składa się z pojedynczego protonu i elektronu, zarówno o obciążeniu wielkości, jak i.
Siła dośrodkowa, która utrzymuje elektron na jego okrągłej orbicie, jest zapewniany przez przyciąganie elektrostatyczne, którego wielkość F to:
F = ke2/R2
Gdzie k jest stałą elektrostatyczną Coulomb i R Law odległość elektron-białko. Wiedząc o tym w ruchu okrągłym przyspieszenie dośrodkoweC Jest podany przez powód między kwadratem prędkości a odległością r:
DoC = v2 / R
Zgodnie z drugim prawem Newtona siła netto jest produktem Mass M przez przyspieszenie:
Mv2/r = ke2/R2
Uzyskuje się uproszczenie radia R:
M⋅V2R = ke2
Łącząc to wyrażenie z ekspresją pędu kątowego, mamy układ równań, podany przez:
Może ci służyć: trajektoria fizyczna: cechy, typy, przykłady i ćwiczenia1) MV2R = ke2
2) r = n H/mv
Chodzi o to, aby rozwiązać system i określić R, promień dozwolonej orbity. Mała podstawowa algebra prowadzi do odpowiedzi:
R = (nH)2 / K⋅m⋅E2
Z n = 1, 2, 3, 4, 5 ..
Dla n = 1 mamy najmniejsze radia, nazywane Bohr Radio aalbo O wartości 0,529 × 10−10 M. Radia innych orbit są wyrażone w kategoriach Doalbo.
W ten sposób Bohr wprowadza główną liczbę kwantową N, wskazując, że dozwolone radia są oparte na stałej Plancka, stałej elektrostatycznej oraz masie i obciążenia elektronu.
BOHR Atomic Model postuluje
 Duński fizyk Niels Bohr (1885-1962).
Duński fizyk Niels Bohr (1885-1962). Bohr umiejętnie łączy newtonowską mechanikę z nowymi odkryciami, które stale dawały w drugiej połowie XIX wieku i na początku XX wieku. Wśród nich rewolucyjna koncepcja „ile”, której sam Planck twierdził, że nie jest bardzo przekonany.
Dzięki swojej teorii Bohr mógł zadowalająco wyjaśnić serię spektrum wodoru i przewidywać emisje energii w stopniu ultrafioletu i podczerwieni, które nie zostały jeszcze zaobserwowane.
Możemy podsumować Twoje postulaty w następujący sposób:
Elektrony opisują okrągłe trajektorie
Elektron obraca się wokół jądra na stabilnej okrągłej orbicie, z jednolitym ruchem okrągłym. Ruch wynika z przyciągania elektrostatycznego, które wywiera na jądro.
Pęd kątowy jest kwantyzowany
Pęd kątowy elektronu jest kwantyzowany zgodnie z wyrażeniem:
L = mvr = nH
Gdzie n jest liczbą całkowitą: n = 1, 2, 3, 4 ..., co prowadzi do elektronu, może znajdować się tylko w określonych orbitach, których radia są:
R = (n H)2 / k M E2
Elektrony emitują lub wchłaniają fotony, gdy przechodzą od jednego stanu energii do drugiego
 Podczas przechodzenia z jednego stanu energii do drugiego elektron wchłania lub emituje energię w dyskretnych ilościach zwanych fotonami. Źródło: Wikimedia Commons.
Podczas przechodzenia z jednego stanu energii do drugiego elektron wchłania lub emituje energię w dyskretnych ilościach zwanych fotonami. Źródło: Wikimedia Commons. Ponieważ pęd kątowy jest kwantyzowany, energia i także. Można wykazać, że E jest podane przez:
Może ci służyć: ujęcie pionowe: wzory, równania, przykłady
Volt Electron lub EV to kolejna jednostka energii, szeroko stosowana w fizyce atomowej. Znak ujemny w energii zapewnia stabilność orbity, wskazując, że należy wykonać pracę w celu oddzielenia elektronu od tej pozycji.
Podczas gdy elektron jest na swojej orbicie, nie wchłania ani emituje światła. Ale kiedy przeskakuje z orbity o większej energii do niższej.
Częstotliwość F emitowanego światła zależy od różnicy między poziomami energii orbit:
E = hf = ewstępny - efinał
Ograniczenia
Model BOHR ma pewne ograniczenia:
-Z powodzeniem dotyczy tylko atomu wodoru. Próby zastosowania go do bardziej złożonych atomów nie działały.
-Nie odpowiada, dlaczego niektóre orbity są stabilne, a inne nie. Fakt, że energia w atomie została skwantowana, działał bardzo dobrze, ale model nie stanowiła powodu, a to było coś, co spowodowało dyskomfort dla naukowców.
-Kolejnym ważnym ograniczeniem jest to, że nie wyjaśniło dodatkowych linii wydanych przez atomy w obecności pól elektromagnetycznych (efekt Zeemana i efekt Stark). Lub dlaczego niektóre linie spektrum były bardziej intensywne niż inne.
-Model BOHR nie uwzględnia efektów relatywistycznych, co jest konieczne.
-Przyjmuje do pewności, że można dokładnie wiedzieć o pozycji i prędkości elektronu, ale tak naprawdę obliczono prawdopodobieństwo, że elektron zajmuje określoną pozycję.
Pomimo swoich ograniczeń, model odniósł wówczas wielki sukces, nie tylko w zakresie integracji nowych odkryć z już znanymi elementami, ale także dlatego, że pokazał nowe pytania, wyjaśniając, że ścieżka do zadowalającego wyjaśnienia atomu była w mechanice kwantowej.
Artykuły zainteresowane
Model atomowy Schrödingera.
Model atomowy Broglie.
Model atomowy Chadwick.
Model atomowy Heisenberga.
Model atomowy Perrina.
Model atomowy Thomsona.
Model atomowy Dalton.
Model atomowy Dirac Jordan.
Model atomowy Democritus.
Model atomowy Leucipo.
Model atomowy Sommerfeld.
Obecny model atomowy.


