Myoglobina

- 4868
- 376
- Arkady Sawicki
 Struktura mioglobiny
Struktura mioglobiny Co to jest mioglobina?
Myoglobina Jest to wewnątrzkomórkowe białko kulkowe występujące w cytosolu komórek mięśni szkieletowych i sercowych. Jego fundamentalną funkcją jest stanowisko rezerwatu tlenu i faworyzowanie wewnątrzkomórkowego transportu tlenu.
John Kendrew i Max Perutz otrzymali Nagrodę Nobla w dziedzinie chemii w 1962 r. Za badania białek kulistych. Autorzy ci wyjaśniają trójwymiarową strukturę odpowiednio mioglobiny i hemoglobiny. Historycznie mioglobina była jednym z pierwszych białek, z których określono trójwymiarową strukturę.
Białka kuliste są zwartymi cząsteczkami o sferycznym kształcie; Są rozpuszczalne w cytosolu lub w części lipidowej błony komórkowej. Są odpowiedzialne za główne działania biologiczne, w przeciwieństwie do białek włóknistych, których główne funkcje są strukturalne.
Myoglobina daje świeże mięso czerwone. Dzieje się tak, gdy mioglobina jest natleniona jako oximioglobina, a żelazo, które ją tworzy.
Gdy mięso jest narażone na środowisko, żelazne, niestabilne, utleniane i staje się żelaze i w tych warunkach zmienia się kolor w brązowe tony do tworzenia metamioglobiny (MB-FE3 + + O2 ●-).
Zwykle poziomy miglobiny krwi są bardzo małe, są one w kolejności mikrogramów na litr (μg/l). Poziomy te rosną, gdy niszczenie mięśni występuje jak w rabdomiolizy mięśni szkieletowych lub w przypadku zawału serca z niszczeniem tkanki i w niektórych miopatiach.
Jego obecność w moczu jest obserwowana w pewnych warunkach, w których uszkodzenie tkanki są bardzo ważne. Jego wczesna wartość diagnostyczna zawału serca jest dyskusyjna.
Może ci służyć: rdzeń komórkiStruktura mioglobiny
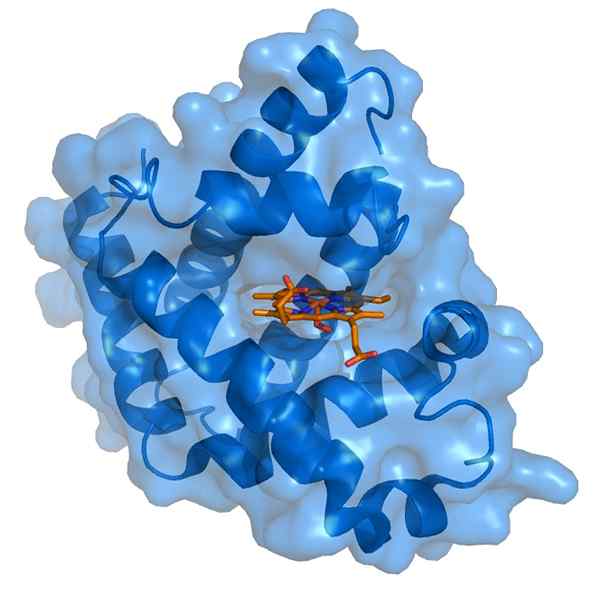 Myoglobina i jej grupa protetyczna hemo (źródło: Thomas Splettttsser/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons)
Myoglobina i jej grupa protetyczna hemo (źródło: Thomas Splettttsser/CC By-S (https: // creativeCommons.Org/licencje/by-sa/3.0) Via Wikimedia Commons) Myoglobina ma masę cząsteczkową prawie 18 kDa, w tym grupę hemo. Składa się z czterech spiralnych segmentów zjednoczonych przez „nagły zwrot”. Te śmigła mioglobiny są ściśle pakowane i utrzymują integralność strukturalną, nawet gdy grupa HEMO jest usuwana.
Struktura białek kulistych, a także wszystkich białek komórkowych, jest hierarchiczna, więc struktura mioglobiny jest również. Pierwszy poziom to podstawowa struktura utworzona przez liniową sekwencję aminokwasów, a mioglobina składa się z łańcucha 153 aminokwasów.
Wtórna struktura mioglobiny polega na tworzeniu śmigła alfa. Myoglobina zawiera 8 śmigieł alfa utworzonych przez powtarzane części polipeptydowe, które wiążą się przez krótkie segmenty zarządzania aperiadowego.
Struktura trzeciorzędowa składa się z trójwymiarowej konformacji z aktywnością biologiczną. Najważniejsze cechy tej struktury są składanie. Struktura czwartorzędowa odnosi się do montażu dwóch lub więcej oddzielnych i zjednoczonych łańcuchów polipeptydowych poprzez nieokowaleniowe łącza lub interakcje.
Myoglobina ma bardzo zwartą strukturę, z odpadami hydrofobowymi skierowanymi w kierunku wewnętrznych i hydrofilowych lub polarnych pozostałości skierowanych na zewnątrz. Wewnętrzne odpady apolarne powstają przez leucynę, walinę, metodę i fenyloalaninę. Jedynymi wewnętrznymi odpadami polarnymi są dwie histydyny, które mają funkcje w aktywnym centrum.
Grupa protetyczna HEMO znajduje się w rozszczepieniu apolarnej wewnętrznej części łańcucha polipeptydowego poliloglobiny. Ta grupa zawiera żelazo w postaci żelaza żelaza, które wiąże się z tlenem z wytworzeniem oximioglobiny.
Może ci służyć: GLUT4: Charakterystyka, struktura, funkcjeFunkcja mioglobiny
Funkcją mioglobiny jest zjednoczenie tlenu do grupy hemo jego struktury i tworzenie rezerwy tlenu do funkcji mięśni. W zakresie, w jakim tlen jest uwięziony w strukturze mioglobiny w cytoplazmie komórki mięśniowej, jej ciśnienie wewnątrzkomórkowe, określone przez wolny tlen, pozostaje niski.
Niskie wewnątrzkomórkowe ciśnienie tlenu utrzymuje gradient wlotu tlenu do komórki. To sprzyja przejściu tlenu od potoku krążenia do komórki mięśniowej. Kiedy mioglobina nasyca wewnątrzkomórkowy tlen, wzrasta, co stopniowo zmniejsza gradient, a tym samym zmniejsza transfer.
Krzywa wiązania tlenu z mioglobiną jest hiperboliczna. W początkowych częściach krzywej niewielkie zmiany częściowego ciśnienia tlenu powodują wielkie zmiany w nasyceniu mioglobiny tlenem.
Następnie, w zakresie, w jakim częściowe ciśnienie tlenu wzrasta, nasycenie nadal rośnie, ale wolniej, to znaczy znacznie większy wzrost częściowego ciśnienia tlenu, aby zwiększyć nasycenie mioglobiny, a stopniowo krzywa spłaszcza się.
Istnieje zmienna, która mierzy powinowactwo krzywej zwanej p50, reprezentuje to ciśnienie częściowe tlenu niezbędne do nasycenia mioglobiny zawartej w roztworze o 50%. Tak więc, jeśli P50 wzrośnie, mówi się, że mioglobina ma mniejsze powinowactwo, a jeśli P50 maleje, mówi się, że mioglobina ma większe powinowactwo do tlenu.
Może ci służyć: proeritroblast: cechy, morfologia, regulacja, barwienieKiedy badane są krzywe wiązania tlenu z mioglobiną i hemoglobiną, obserwuje się, że dla dowolnego częściowego ciśnienia tlenu, mioglobina jest nasycona, a nie hemoglobiną, co wskazuje, że mioglobina ma większe powinowactwo do tlenu niż tlenu niż tlen.
Rodzaje włókien mięśniowych i mioglobiny
Mięśnie szkieletowe mają różne rodzaje włókien mięśniowych w swoim składzie, niektóre powolne połączenia kontrakcyjne i inne o szybkim skurczu. Włókna szybkiego skurczu są strukturalnie i metabolicznie przystosowane do szybkiego i energicznego kontraktowania się i w sposób beztlenowy.
Wolne skurcze włókien są dostosowywane do niskiej prędkości, ale bardziej przedłużone skurcze, typowe dla ćwiczeń oporowych aerobowych. Jedną z różnic strukturalnych tych włókien jest stężenie mioglobiny, co nadaje im nazwę białych i czerwonych włókien.
Czerwone włókna mają wysoką zawartość mioglobiny, co daje im czerwony kolor, ale pozwala im również utrzymać duże ilości tlenu, co jest niezbędne dla ich funkcji.
Wartości normalne
Normalne wartości krwi u mężczyzn wynoszą od 19 do 92 µg/l, a u kobiet od 12 do 76 µg/L, jednak istnieją różnice w wartościach w różnych laboratoriach.
Wartości te rosną, gdy niszczenie mięśni występuje, jak w rabdomiolizy mięśni szkieletowych, w rozległych oparzeniach, wstrząsach elektrycznych lub w rozległej martwicy mięśni z powodu niedrożności tętniczej, w zawale mięśnia sercowego i w niektórych krótkowzroczności.
W tych warunkach mioglobina pojawia się w moczu i nadaje jej charakterystyczny kolor.

