Charakterystyka miofibryli, struktura, skład, funkcje
- 2559
- 534
- Herbert Wróblewski
Miofibryle Są to jednostki strukturalne komórek mięśniowych, znane również jako włókna mięśniowe. Są bardzo obfite, są ustalane równolegle i są osadzone przez cytosol tych komórek.
Przebite komórki włókien mięśniowych lub włókna to bardzo długie komórki, które są w stanie zmierzyć do 15 cm długości i od 10 do 100 μm średnicy. Jego błona plazmatyczna jest znana jako sarkolema i cytosol jako sarkoplasma.
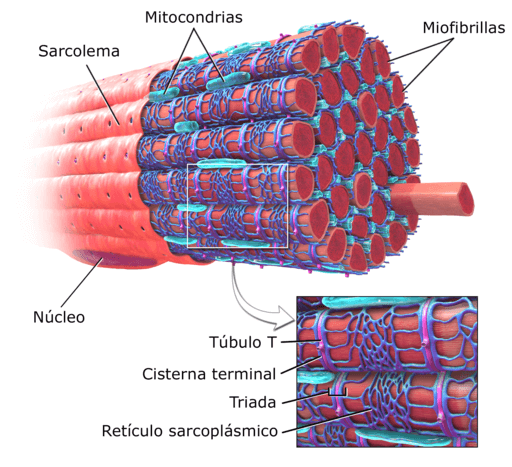
 Schemat struktury mięśni istoty ludzkiej (źródło: deglr6328 ~ commonswiki, przez wikimedia Commons)
Schemat struktury mięśni istoty ludzkiej (źródło: deglr6328 ~ commonswiki, przez wikimedia Commons) W tych komórkach znajdują się oprócz miofibryli, wiele jąder i mitochondriów, które są znane jako sarkosomy, a także widoczne retikulum endoplazmatyczne znane jako siatkówka sarkoplazmatyczna.
Myofibryle są uznawane za „elementy skurczowe” mięśni u zwierząt kręgowców. Składają się z różnych rodzajów białek, które są te, które nadają im elastyczne i chowane cechy. Ponadto zajmują ważną część sarkoplazmy włókien mięśniowych.
[TOC]
Różnice między włóknami mięśniowymi
Istnieją dwa rodzaje włókien mięśniowych: włókna prążkowane i gładkie, każdy z rozkładem anatomicznym i funkcją określoną. Myofibryle są szczególnie ważne i widoczne w prążkowanych włókienach mięśniowych, które tworzą mięśnie szkieletowe.
Włókna prążkowane mają powtarzający się wzór pasm poprzecznych, gdy są one obserwowane przy mikroskopie i są związane z mięśniami szkieletowymi i częścią mięśni serca.
Wręcz przeciwnie, gładkie włókna nie przedstawiają tego samego wzoru pod mikroskopem i znajdują się w charakterystycznych mięśniach naczyń naczyń i układu trawiennego (i wszystkich wnętrzności).
Ogólne cechy
Myofibryle składają się z dwóch rodzajów włókien skurczowych (znanych również jako miofilamenty), które z kolei składają się z białek miozyny i aktyny, które zostaną opisane później.
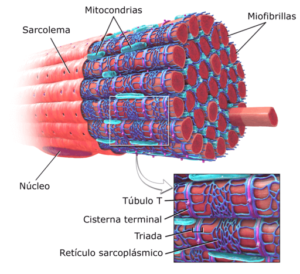 Reprezentacja graficzna miofibryli w mięśniach szkieletowych (źródło: zmodyfikowane Bublaus [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons)
Reprezentacja graficzna miofibryli w mięśniach szkieletowych (źródło: zmodyfikowane Bublaus [CC BY-SA 3.0 (https: // creativeCommons.Org/licencje/by-sa/3.0)] przez Wikimedia Commons) Różni badacze ustalili, że średni czas życia białek skurczowych miofibryli trwa z 5 dni do 2 tygodni, więc mięsień jest wysoce dynamiczną tkanką, nie tylko z kurczliwego punktu widzenia, ale z syntezą i odnowy jego elementów strukturalnych.
Jednostka funkcjonalna każdej miofibrylli w komórkach mięśniowych lub włókien jest nazywana mięsakiem i jest ograniczona przez region znany jako „pasmo lub linia z”, z którego miofilamenty aktyny są rozszerzone równolegle.
Ponieważ miofibryle zajmują znaczną część sarkoplazmy, te włókniste struktury ograniczają lokalizację centrów komórek, na które należą one do peryferii tego samego, w pobliżu sarkę.
Może ci służyć: komórka ludzka: cechy, funkcje, części (organelle)Niektóre ludzkie patologie są związane z przemieszczeniem jąder do wiązek miofibrylarnych, które są znane jako miopatie środkowe-nuklearne.
Tworzenie miofibryli lub „miofibrylogenezy”
Pierwsze miofilki są składane podczas rozwoju embrionalnego mięśnia szkieletowego.
Białka, które składają się na sarkomenów (jednostki funkcjonalne miofibryli) są początkowo wyrównane z końca i boków „nagrody”, które składają się z włókien aktyny i niewielkich części miozyny II niemięśniowej i specyficznej dla α.
Jak to dzieje się, we włóknach mięśniowych wyrażają, w różnych proporcjach, geny kodujące dla izoform sercowych i szkieletowych α-aktyny. Najpierw ilość wyrażonej izoformy serca jest większa, a następnie zmienia się to w szkielecie.
Po utworzeniu nagrody powstające miofibryle są składane za strefą tworzenia nagród, aw tych postaci mięśniowej miozyny II.
W tym momencie włókna miozyny są wyrównane i złożone z innymi specyficznymi białkami Unii miozyny, które występują również w przypadku włókien aktyny.
Struktura i skład
Jak wspomniano przed chwilą, miofibryle składają się z mięśniowych białka skurczowego: aktyna i miozyny, które są również znane również jako cienkie i grube miofilamenty,. Są one widoczne dla mikroskopu optycznego.
- Cienkie miofilamenty
Cienkie włókna miofibryli składają się z białka aktyny w jej nitkowatej formie (aktyna F), która jest polimerem w kształcie kulistym (aktyna), który ma mniejszy rozmiar.
Nitkowate nici aktyny (aktyny f) tworzą podwójną nici, która jest owinięta w kształt śmigła. Każdy z nich waży mniej więcej 40 kDa i jest w stanie dołączyć do miozyny w określonych miejscach.
Te włókna mają średnicę około 7 nm i rozciągają się między dwoma obszarami znanymi jako pasmo I i pasm a. W zespole A włókna te znajdują się wokół grubych włókien, tworząc wtórny układ sześciokąta.
W szczególności każdy cienki filament jest symetrycznie oddzielony od trzech grubych włókien, a każde grube włókno jest otoczone sześcioma cienkimi włóknami.
Cienkie i grube włókna oddziałują ze sobą przez „mosty krzyżowe”, które wyróżniają się na tle grubych włókien i które pojawiają się w strukturze miofibrylli w regularnych odstępach odległości blisko 14 nm.
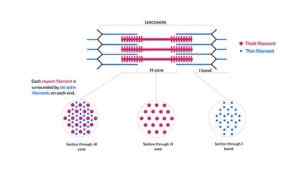 Schematyczne przedstawienie miofilamentów, które składają się na miofibryle i ich krzyżowe cięcia (źródło: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons)
Schematyczne przedstawienie miofilamentów, które składają się na miofibryle i ich krzyżowe cięcia (źródło: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // creativeCommons.Org/licencje/nabrzeże/4.0)] przez Wikimedia Commons) Włókna aktyny i inne powiązane białka rozciągają się na „krawędzie” linii Z i nakładają się na włókna miozyny w kierunku środka każdego sarcomero.
Może ci służyć: żywieniowe: procesowe i składniki odżywcze- Grube miofilamenty
Grube włókna są polimerami białka miozyny II (510 kDa każdy) i są ograniczone przez regiony znane jako „pasma A”.
Myofilamenty miozyny mają około 16 nm długości i są rozmieszczone w układach sześciokątnych (jeśli obserwuje się przekrój miofibrylli).
Każde włókna miozyny II składa się z wielu zapakowanych cząsteczek miozyny, z których każda składa się z dwóch łańcuchów polipeptydowych, które mają region lub „głowę” w postaci maza i które pomieści w „pęczkach” w celu utworzenia włókien.
Oba wiązki są utrzymywane przez swoje końce na środku każdego sarcomero, tak że „głowy” każdej miozyny są skierowane w kierunku linii Z, gdzie cienkie włókna są ustalane.
Głowy miozyny wypełniają bardzo ważne funkcje, ponieważ mają miejsca związkowe dla cząsteczek ATP, a ponadto podczas skurczu mięśni są w stanie utworzyć mosty krzyżowe do interakcji z cienkimi włóknami aktyny.
- Powiązane białka
Włókna aktyny są „zakotwiczone” lub „naprawy” błony plazmatycznej włókien mięśniowych (sarkoma) dzięki interakcji z innym białkiem znanym jako dystrofina.
Ponadto istnieją dwa ważne białka z Unii Aktyny znane jako troponina i tropomiozyna, które wraz z włóknami aktyny tworzą kompleks białkowy. Oba białka są niezbędne do regulacji interakcji, które zachodzą między cienkimi i grubymi włókienami.
Tropomiozyna jest również dwuosobową cząsteczką włóknistą, która jest związana z aktyną proponującą specyficznie w obszarze rowkowym, które występują między dwoma niciami. Troponina jest trójstronnym kompleksem białek kulistych, który jest dostępny w odstępach czasu o włókien aktyny.
Ten ostatni kompleks działa jako „przełącznik” zależny od wapnia, który reguluje procesy skurczu włókien mięśniowych, więc ma to najwyższe znaczenie.
W prążkowym mięśniu zwierząt kręgowców istnieją dwa inne białka, które oddziałują z grubymi i cienkimi włóknami, znanymi odpowiednio jako Titina i Nebulina.
Nebulina pełni ważne funkcje w regulacji długości włókien aktyny, podczas gdy Titina uczestniczy w wsparciu i zakotwiczeniu włókien miozyny w regionie Sarcomero znanego jako linia M.
Inne białka
Istnieją inne białka związane z gęstymi miofilamentami, które są znane jako białko C miozyny i mianezów, które są odpowiedzialne za ustalanie włókien miozyny w linii M.
Może ci służyć: Unaporto: transport przez błony, cechyFunkcje
Miofibryle mają podstawowe implikacje w zakresie poruszania zwierząt kręgowców.
Ponieważ są one składane przez włókniste i skurczowe kompleksy białkowe aparatu mięśniowego, są one niezbędne do wykonywania odpowiedzi na bodźce nerwowe, które prowadzą do ruchu i przemieszczenia (w mięśniach szkieletowych).
Niedopuszczalne dynamiczne właściwości mięśnia szkieletowego, który obejmuje ponad 40% masy ciała, są przyznawane przez miofibryle, które jednocześnie mają 70% ludzkich białek ciała między 50 a 70%.
Myofibryle, w ramach tych mięśni, uczestniczą we wszystkich swoich funkcjach:
- Mechanika: Aby przekształcić energię chemiczną w energię mechaniczną w celu generowania siły, utrzymania postawy, wytwarzania ruchów itp.
- Metaboliczny: Ponieważ mięsień uczestniczy w metabolizmie energii podstawowej i służy jako miejsce przechowywania podstawowych substancji, takich jak aminokwasy i węglowodany; Przyczynia się również do wytwarzania ciepła i zużycia energii i tlenu wykorzystywanych podczas aktywności fizycznej lub ćwiczeń sportowych.
Ponieważ miofibryle składają się głównie z białek, reprezentują one miejsce przechowywania i uwalniania aminokwasów, które przyczyniają się do utrzymania poziomu glukozy we krwi podczas postu lub głodu.
Również wyzwolenie aminokwasów z tych struktur mięśniowych ma transcendencję z punktu widzenia biosyntetycznych potrzeb innych tkanek, takich jak skóra, mózg, serce i inne narządy.
Bibliografia
- Despoulos, a., & Silbernagl, s. (2003). Atlas koloru fizjologii (Ed.). Nowy Jork: Thieme.
- Friedman, a. L., I Goldman i. I. (1996). Mechaniczna charakterystyka miofibryli mięśni szkieletowych. Biofizyczny dziennik, 71(5), 2774-2785.
- Border, w. R., & Ochala, J. (2014). Mięsień szkieletowy: krótki przegląd struktury i funkcji. Calkif tkanki int, Cztery pięć(2), 183–195.
- Goldspink, g. (1970). Proliferacja miofibryli podczas wzrostu błonnika mięśniowego. J. Komórka SCT., 6, 593-603.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Rosen, J. N., & Baylies, m. K. (2017). Miofibryle kładą ściskanie na jądro. Biologia komórek przyrody, 19(10).
- Sanger, J., Wangs, J., Fan i., White, J., Mi-MY, L., Dube, d.,... Pruyne, D. (2016). Montaż i utrzymanie miofibryli w mięśniach rozbijackich. W Podręcznik eksperymentalnej farmakologii (P. 37). Nowy Jork, USA: Springer International Publishing Szwajcaria.
- Sanger, J. W., Wang, J., Fan i., White, J., & Sanger, j. M. (2010). Montaż i dynamika miofibryli. Journal of Biomedicine and Biotechnology, 2010, 8.
- Sobiesz, a., I Bremel, R. (1975). Przygotowanie i właściwości kręgowców gładkich - miofibryle mięśni i aktomyozyna. Europejski Journal of Biochemistry, 55(1), 49-60.
- Villee, c., Walker, w., & Smith, F. (1963). Ogólna zoologia (2 wyd.). Londyn: w. B. Saunders Company.
- « Charakterystyka lobelii, siedlisko, dystrybucja, gatunki
- Charakterystyka głowonogów, siedlisk, reprodukcji, odżywiania »

