Charakterystyka metioniny, funkcje, żywność, korzyści

- 3940
- 22
- Bertrand Zawadzki
Menioniina (Met, M) jest aminokwasem sklasyfikowanym w grupie aminokwasów hydrofobowych lub apolowych. Ten aminokwas zawiera siarkę w łańcuchu bocznym, który może reagować z atomami metali lub grupami elektrofilowymi.
Metionine został odkryty przez Johna Howarda Muellera w drugiej dekadzie XX wieku. Mueller wyizolował metodę z kazeiny, białka, którego zastosował do wzrostu hemolitycznych upraw streptococci.
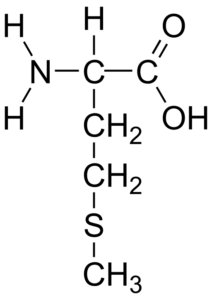 Struktura chemiczna aminokwasowego metioniny (źródło: HBF878 [CC0] przez Wikimedia Commons)
Struktura chemiczna aminokwasowego metioniny (źródło: HBF878 [CC0] przez Wikimedia Commons) Nazwa „metioniny” jest skrótem chemicznej nazwy tego aminokwasu: kwas γ-metylo-α-aminobutirowy i została wprowadzona przez S przez S. Odake w 1925 r.
Jest niezbędnym aminokwasem dla ssaków i może wejść na drogę syntezy cystein. Rośliny i bakterie syntetyzują z homocysteiny, pochodnej cysteiny i homoseryny.
Jego katabolizm implikuje z jednej strony eliminacja azotu z jego struktury i wydalania jako mocznika, a z drugiej, transformacja jego węglowanego łańcucha w COA sukcynyl.
Razem z waliną i treminą, metionina jest uważana za glikogenny aminokwas, ponieważ aminokwasy te mogą stać się bursztynianem i wejść do cyklu Krebsa. Glikogenne aminokwasy są w stanie powodować węglowodany, a zatem glukozę.
Istnieje wiele potraw, takich jak tuńczyka, mięso, białko jaja, sery i orzechy.
Metionina jest niezbędna do syntezy wielu białek, spełnia ważne funkcje w metabolizmie tłuszczu, głównie w przypadku mięśni szkieletowych, a także uczestniczy jako przeciwutleniacz.
Istnieje wiele zaburzeń związanych z metabolizmem metody i siarki, które są związane z patologią o różnym stopniu implikacji zdrowotnych. Niektórzy indukują akumulację homocysteiny, której towarzyszy zakrzepica, zmiany ośrodkowego układu nerwowego (CNS), poważne upośledzenie umysłowe i układ szkieletowy.
Inne, takie jak brak adenozylotransferazy, który jest pierwszym enzymem, który działa w degradacji metody, powodują akumulację metody, stosunkowo łagodną patologię kontrolowaną przez ograniczenie pokarmów bogatych w dietetyczną metioninę.
[TOC]
Charakterystyka
Menioniina jest niezbędnym aminokwasem, który nie jest wytwarzany przez ludzkie ciało lub przez wielu. To doskonały przeciwutleniacz i źródło siarki dla naszego ciała.
Codzienne wymagania metaoniny dla niemowląt wynoszą 45 mg/dzień, u dzieci wynosi 800 mg/dzień, a u dorosłych wynosi od 350 do 1.100 mg/dzień.
Metionina jest jednym z głównych źródeł siarki organizmu; Siarka jest podstawowym składnikiem niektórych witamin, takich jak tiamina lub witamina B1, niektórych hormonów, takich jak glukagon, insulina i niektóre hormony przysadki mózgowej.
Jest w keratynie, która jest białkiem skóry, paznokci i włosów, a także jest ważne dla synteza kolagenu i kreatyny. Dlatego metoda bycia źródłem siarki jest związana ze wszystkimi funkcjami zawierającej ją.
Struktura
Chemiczna wzór metaoniny to H2CCH (NH2) CH2CH2SCH3, a jej wzór molekularny to C5H11NO2S. Jest to niezbędny hydrofobowy aminokwas, sklasyfikowany do aminokwasów apolowych.
Ma węgiel α przymocowany do grupy aminowej (-NH2), grupy karboksylowej (-COH), do atomu wodoru i łańcucha bocznego (-R), który zawiera siarkę i jest to określone w następujący sposób: -ch2 -ch2- S-ch3.
Może ci służyć: 12 etapów rozwoju człowieka i jego cechyWszystkie aminokwasy, z wyjątkiem glicyny, mogą istnieć jako enancjomery w L O D, więc mogą istnieć L-metionina i d-metionina. Jednak tylko L-metionina znajduje się w strukturze białek komórkowych.
Ten aminokwas ma pewne stałe dysocjacji pk 1 z 2.28 i PK2 z 9.21 i punkt izoelektryczny 5.8.
Funkcje
Metionina jest niezbędnym aminokwasem do syntezy wielu białek, w tym niektóre hormony, białka stanowiące skórę, włosy i paznokcie itp.
Jest stosowany jako naturalny środek do spania i jest bardzo ważny dla dobrego stanu paznokci, skóry i włosów. Zapobiega niektórym chorobom wątroby i serca; Unikaj akumulacji tłuszczów w tętnicach i jest niezbędny do syntezy cysteiny i walki byków.
Faworyzuje stosowanie tłuszczów jako energii i interweniuje w ich transporcie i ich użyciu, szczególnie w mięśniach szkieletowych, więc jest bardzo ważne do ćwiczeń mięśniowych.
Zmniejsz poziomy histaminy. Jest to naturalny przeciwutleniacz, ponieważ pomaga zmniejszyć wolne rodniki. Ma również właściwości przeciwdepresyjne i przeciwlękowe.
Kolejne niedawne zastosowanie metaioniny jako „radia” do badania obrazowego w tomografii emisji pozitronów (PET) w dziedzinie neuro-arnicology.
Ma również szeroko zakrojone zastosowanie jako radio-czołowo dla glejaków, zarówno w procesie planowania ekstrakcji chirurgicznych, jak i do monitorowania odpowiedzi na leczenie i ocenę nawrotów.
Ostatnio zastosowanie metody zostało skutecznie przetestowane w celu poprawy wzrostu roślin sojowych.
Biosynteza
Biosynteza Mentionine została opisana i opublikowana w 1931 roku przez British George Barger i jego asystent Frederick Philip Coine.
Bakterie i rośliny mogą syntetyzować metioninę i cysteinę, jednak większość zwierząt uzyskuje dietę i metodę cysteinową z biosyntetycznej trasy, która zaczyna się od metaoniny jako początkowego podłoża (nabywają również cysteinę z żywnością spożywaną w diecie).
Trasa biosintetyczna
Rośliny i bakterie wykorzystują cysteinę jako źródło siarki i homoseriny jako źródła szkieletu gazowanego do syntezy metody. Homoserina syntetyzuje z asparaginianu za pomocą trzech reakcji enzymatycznych:
(1) asparaginian staje się fosforanem β-asfate przez enzym kinazę asparaginianową, a następnie (2) staje się β-semi-aserttyczny asparys, który (3) dzięki działaniu dehydrogenazy homoserynowej wytwarzają homoserynę.
Pierwszym etapem syntezy metaioniny jest reakcja homoseriny z sucynylo-CoA z wytworzeniem homoseriny o-succynil. W tej reakcji sucynylo-CoA jest podzielony, co uwalnia część CoA, a bursztynian wiąże się z homoseriną.
Na trasie biosyntetycznej przepustka regulowana lub kontrolna.
Drugim etapem syntezy jest reakcja homoserine O-succynil z cysteiną, która jest katalizowana przez enzym cystationinowy γ-scetaza, z wytwarzaniem cystationiny.
Trzecia reakcja tej trasy jest katalizowana przez β-cystationinina, która rozbija cystatytunę, dzięki czemu siarka jest powiązana z łańcuchem bocznym czterech atomów węgla, który wywodzi się z homoseryny. Rezultatem tej reakcji jest tworzenie homocysteiny i uwalnianie 1 pirogronianu i 1 jonu NH4+.
Może ci służyć: Flora i fauna w Kolumbii: reprezentatywne gatunki (zdjęcia)Ostatnia reakcja jest katalizowana przez homocysteinę metylotransferazy, która ma substrat do homocysteiny, a obok koenzymu metylokokobalaminy (pochodzących od grupy witaminy B12 do homocysteiny do homocysteiny do homocysteiny do homocysteiny).
W tej reakcji tetrahydrofolan jest wolny.
Degradacja
Metionina, izoleucyna i walina są katabolizowane do sukcynlu-CoA. Trzy piąte węgle metioniny formy succynylo-CoA, Carboxilli Wa'a tworzą CO2, a metoda metody jest eliminowana jako taka.
Pierwszy krok w degradacji metaoniny implikuje kondensację L-metioniny z ATP przez transferazę adenozylową L-metioninę, co daje powstanie S-adenozylo-L-metioniny, zwaną także „metodą aktywną”.
Grupa S-metylowa jest przenoszona do kilku akceptorów, a zatem powstaje S-adenozylo-l-homocysteina, która traci hydrolizę adenozyną i staje. Następnie homocysteina dołącza do seryny, tworząc cystationinę. Ta reakcja jest katalizowana przez β-scetazę cystationinę.
Cystationina jest hydrolizowana i powoduje powstanie L-homoseriny i cysteiny. W ten sposób homocysteina powoduje homoserynę i serynę generują cysteinę, więc ta reakcja jest powszechna w biosyntezy cysteiny z seryny.
Następnie homoseryna Atominaza przekształca homoserynę w α-cetobutiran, uwalniając NH4. Α-ecthobutiran, w obecności postaci COA-SH i NAD+, propionilo-CoA, która następnie staje się metylomalonil-coa i staje się to sugerilil-CoA.
W ten sposób część gazowanego łańcucha metioniny kończy się glukoneogennym substratem, sucynylo-CoA, który można następnie zintegrować z syntezą glukozy; Z tego powodu metionina jest uważana za glukogenne aminokwas.
Alternatywną drogą do degradacji metody jest jej zastosowanie jako substrat energetyczny.
Azot meoniowy, taki jak wszystkie aminokwasy, jest usuwane z węgla α-transaminacji, a ta grupa α-amino jest ostatecznie przenoszona na l-glutaminian. Z powodu złamanego serca, że azot wchodzi do cyklu mocznika i jest eliminowany przez mocz.
Metionine Foods
Wśród pokarmów bogatych w metioninę są:
- Biała jaja.
- Pochodne nabiału, takie jak dojrzały ser, ser śmietankowy i jogurt.
- Ryby, zwłaszcza niebieskie ryby, takie jak tuńczyk lub miecznik.
- Krab, homar i krewetki są ważnymi źródłami metaoniny.
- Mięso wieprzowe, krowie i kurczaka.
- Orzech i inne orzechy są bogate w metioninę i reprezentują substytuty białka wegetarianom i wegańskie.
- Nasiona sezamu, dynia i pistacja.
Występuje również w białej i czarnej fasoli, w soi, w kukurydzy i zielonych warzywach liściastych, takich jak liście rzepy, szpinak i chard. Brokuły, cukinia i dynia są bogate w metioninę.
Korzyści z Twojego spożycia
Będąc niezbędnym aminokwasem, jego spożycie jest niezbędne, aby wypełnić wszystkie funkcje, w których uczestniczy. Wspierając transport tłuszczów do paliwa energetycznego, metaoniina chroni wątrobę i tętnice przed nagromadzeniem tłuszczów.
Jego spożycie jest korzystne dla ochrony organizmu przed warunkami, takimi jak stłumiona wątroba i miażdżyca.
Metionina okazała się skuteczna w leczeniu niektórych ciężkich przypadków szpikuroopatii indukowanych przez niedokrwistość tlenku azotu i makrocytarne, które nie reagują na leczenie witaminą B12.
Może ci służyć: flora i fauna de morelosZastosowanie S-adenozylo-L-metioniny (SAM) jest skuteczne jako naturalne i alternatywne leczenie depresji. Jest tak, ponieważ Sam jest dawcą grup metylowych, który bierze udział w syntezie kilku neuroprzekaźników o właściwościach przeciwdepresyjnych w mózgu.
Stres oksydacyjny jest zaangażowany, przynajmniej częściowo, w uszkodzeniu kilku narządów, w tym wątroby, nerek i mózgu. Zastosowanie przeciwutleniaczy, takich jak metionina, w celu zapobiegania i skorygowania uszkodzeń spowodowanych stresem oksydacyjnym.
Zaburzenia niedoboru
Istnieją pewne patologie związane z metabolizmem metaoniny, które mają związek z ich absorpcją jelit, co powoduje akumulację niektórych metabolitów lub szczery deficyt aminokwasowego.
W przypadku zaburzeń metabolicznych metaoniny najczęstszymi są homokistinuriami, które są typu I, II, III i IV:
Homocystinurias typu I są spowodowane deficytem cystationiny β-scetaza i towarzyszą im objawy kliniczne podobne do zakrzepicy, osteoporozę, ludność soczewki i często opóźnienie umysłowe.
Homocystinurias typu II są wytwarzane przez deficyt N5N10-metylolentetrahydrofolan. Homocystinurias typu III są spowodowane zmniejszeniem N5-metylotetrahydrofolan-homocysteinę, przez deficyt syntezy metylokobalaminy.
I wreszcie homocystinurias typu IV są związane ze zmniejszeniem N5-metylotetrahydrofolan-homocysteiny z powodu wadliwej absorpcji kobalaminy.
Homocystinurias są dziedziczne wady metabolizmu metody i są prezentowane z częstotliwością w 1 na 160.000 noworodków. W tej patologii około 300 mg homokistyny jest wydalane codziennie wraz z s-adenozylowym metioniną, której towarzyszy wzrost metioniny w osoczu.
Zmniejszenie spożycia metody i wzrost cysteiny w diecie we wczesnych stadiach życia pozwala uniknąć zmian patologicznych wywołanych przez te choroby i pozwala na normalny rozwój.
W przypadku deficytu Minionine Malabsorpcji, najważniejsze skutki związane są z awarią w mielinowaniu włókien nerwowych ośrodkowego układu nerwowego (CNS), które mogą być związane z pewnym stopniem opóźnienia umysłowego.
Bibliografia
- Bakhoum, g. S., Badr, e. DO. Ich., Sadak, m. S., Kabesh, m. ALBO., & Amin, G. DO. (2018). Poprawa wzrostu, aspekty biochemiczne SOM i wydajność trzech odmian roślin sojowych przez obróbkę metioniny w stanie piaszczystym gleby. International Journal of Environmental Research, 13, 1-9.
- Mathews, c., Van Holde, K., & Ahern, K. (2000). Biochemia (3 wyd.). San Francisco, Kalifornia: Pearson.
- Mischoulon, zm., & Fava, m. (2002). Rola S-adenozylo-l-metioniny w leczeniu depresji: przegląd dowodów. American Journal of Clinical Nutrition, 76(5), 1158S-1161S.
- Murray, r., Bender, d., Botham, k., Kennelly, s. 1., Rodwell, v., I Weil, p. (2009). Ilustrowana biochemia Harpera (28. wyd.). McGraw-Hill Medical.
- Patra, r. C., Swarup, d., I Dwivedi, s. K. (2001). Wpływ przeciwutleniający α tokoferolu, kwasu askorbinowego i L-metioniny na stres oksydowy wywołany ołów na wątrobę, nerkę i mózg u szczurów. Toksykologia, 162(2), 81-88.
- Rawn, J. D. (1998). Biochemia. Burlington, Massachusetts: Neil Patterson Publishers.
- Stacy, c. B., Di rocco, do., I Gould, R. J. (1992). Metionina w leczeniu neuropatii indukowanej nitro-tlenkiem i szpiczakiem. Journal of Neurology, 239(7), 401-403.

