Prawo formuły i jednostek gazów idealnych, zastosowania, przykłady

- 4329
- 181
- Matylda Duda
Prawo gazów idealnych Jest to równanie stanu, które opisuje związek między funkcjami stanu związany z gazem idealnym; takie jak temperatura, ciśnienie, objętość i mole. To prawo pozwala na badanie prawdziwych systemów gazowych porównujących je z ich wyidealizowanymi wersjami.
Gaz idealny jest gazem teoretycznym, złożonym z specyficznych lub sferycznych cząstek, które poruszają się losowo; Z wielką energią kinetyczną, gdzie jedyną interakcją między nimi są całkowicie elastyczne starcia. Ponadto przestrzegają idealnego prawa gazu.
 Prawo gazu idealnego pozwala na badanie i zrozumienie wielu prawdziwych systemów gazowych. Źródło: Pxhere.
Prawo gazu idealnego pozwala na badanie i zrozumienie wielu prawdziwych systemów gazowych. Źródło: Pxhere. Przy standardowym ciśnieniu i temperaturze (STP): 1 atm ciśnienia i temperaturze 0 ° C, większość rzeczywistych gazów zachowuje się jakościowo jak gazy idealne; pod warunkiem, że ich gęstości są niskie. Duże odległości międzycząsteczkowe lub międzyatomiczne (w przypadku gazów szlachetnych) ułatwiają takie podejścia.
W warunkach STP tlen, azot, wodór, gazy szlachetne i niektóre gazy złożone, takie jak dwutlenek węgla, zachowują się jak gaz idealny.
Model gazu idealnego upadają w niskich temperaturach, wysokich ciśnieniach i gęstości wysokościowych; Kiedy interakcje międzycząsteczkowe, a także wielkość cząstek, stają się ważne.
Prawo idealne gazów jest składem trzech przepisów Gase: Prawo Boyle i Mariotte, prawa Karola i Gay-Lussaca oraz prawa Avogadro.
[TOC]
Formuła i jednostki

Prawo gazów jest wyrażane matematycznie z formułą:
PV = NRT
Gdzie p jest ciśnienie wywierane przez gaz. Zazwyczaj wyraża się to za pomocą jednostki atmosfery (ATM), chociaż można go wyrazić w innych jednostkach: MMHG, Pascal, Bar itp.
Tom V zajmowany przez gaz jest zwykle wyrażany z jednością litra (L). Chwila N Jest to liczba moli, r uniwersalna stała gazów i T temperatura wyrażona w Kelvin (K).
Najczęściej stosowana ekspresja w gazach R jest równoważna 0,08206 L · atm · k-1· Mol-1. Chociaż jednostka dla stałej gazu ma wartość 83145 J · mol-1· K-1. Oba są ważne, o ile są ostrożne w przypadku jednostek innych zmiennych (P, T i V).
Prawo idealne gazów to połączenie prawa Boyle-Maleotte, prawa Charlesa-Gay-Lussa i prawa Avogadro.
Boyle-Maleotte Law
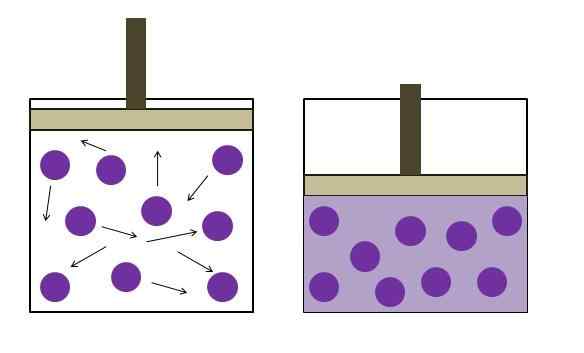 Zwiększone ciśnienie redukcji ciśnienia. Źródło: Gabriel Bolívar
Zwiększone ciśnienie redukcji ciśnienia. Źródło: Gabriel Bolívar Został sformułowany niezależnie przez fizyka Roberta Boyle'a (1662) oraz fizycznego i botanika Edme Mariotte (1676). Prawo jest określone w następujący sposób: W stałej temperaturze objętość stałej masy gazu jest odwrotnie proporcjonalna do wywieranego przez niego ciśnienia.
Może ci służyć: terpenosPV ∝ K
Używając dwóch punktów:
P1V1 = P2V2
Prawo Charles-Gay-Lussac
 Chińskie latarnie lub życzenia. Źródło: Pxhere.
Chińskie latarnie lub życzenia. Źródło: Pxhere. Prawo zostało opublikowane przez Gay-Lussac w 1803 r., Ale odniósł się do pracy nie opublikowanej przez Jacquesa Charlesa (1787). Z tego powodu prawo jest znane jako prawo Karola.
Prawo stwierdza, że przy stałym ciśnieniu istnieje bezpośredni stosunek proporcjonalności między objętością zajmowaną przez gaz i jego temperaturą.
V ∝ k2T
Używając dwóch punktów:
V1/T1 = V2/T2
V1T2 = V2T1
Prawo Avogadro
Prawo zostało podane przez Amadeo Avogadro w 1811 r.
V1/N1 = V2/N2
Co ustanawia prawo gazów idealnych?
Poprzez prawo gazów idealnych ustalono związek między czterema niezależnymi właściwościami gazu: ciśnienie, objętość, temperatura i ilość gazu. Wystarczy znać wartość trzech z nich, aby uzyskać wartość pozostałych.
Prawo ustanawia warunki wskazujące, kiedy gaz zachowuje się idealnie, a kiedy odchodzi od tego zachowania.
Na przykład współczynnik kompresji SO (PV/NRT) ma wartość 1 dla gazów idealnych. Wartość wartości 1 dla współczynnika kompresji wskazuje, że zachowanie gazowe odsuwa się od gazu idealnego.
Dlatego przy zastosowaniu równania gazów idealnych do gazu popełniono błąd, który nie zachowuje się zgodnie z modelem.
Aplikacje
Obliczanie gęstości i masy molowej gazu
Równanie idealnego prawa gazu można zastosować do obliczania gęstości gazu i jego masy molowej. Podczas dokonywania prostej modyfikacji można znaleźć wyrażenie matematyczne, które wiąże gęstość (d) gazu i jego masę molową (M):
D = MP/RT
I oczyszczanie M:
M = drt/p
Obliczanie objętości gazu wytwarzanego w reakcji chemicznej
Stochiometria to gałąź chemii, która dotyczy ilości każdej z odczynników obecnych z produktami zaangażowanymi w reakcję chemiczną, zwykle wyrażaną w molach.
Zastosowanie równania gazów idealnych umożliwia określenie objętości gazu wytwarzanego w reakcji chemicznej; Ponieważ z reakcji chemicznej można uzyskać liczbę moli. Następnie można obliczyć objętość gazu:
Może ci służyć: szklany jonomer: przygotowanie, właściwości, typy, użyciaPV = NRT
V = nrt/p
Pomiar V może określić wydajność lub postęp wspomnianej reakcji. Gdy nie ma już gazów, wskazuje, że odczynniki całkowicie się wyczerpały.
Obliczanie ciśnień częściowych gazów obecnych w mieszaninie
Można zastosować prawo gazów idealnych wraz z prawem częściowej presji Daltona, aby obliczyć ciśnienie częściowe różnych gazów obecnych w mieszaninie gazowej.
Związek jest stosowany:
P = nrt/v
Aby znaleźć ciśnienie każdego z gazów obecnych w mieszaninie.
Objętość gazu zebrana w wodzie
Wystąpiła reakcja, która wytwarza gaz, który jest zbierany przez eksperymentalny projekt w wodzie. Całkowite ciśnienie gazu jest znane plus ciśnienie pary wodne. Wartość tych ostatnich można uzyskać w tabeli, a przez odejmowanie ciśnienie gazowe można obliczyć.
Z stechiometrii reakcji chemicznej można uzyskać liczbę moli gazu i zastosować związek:
V = nrt/p
Objętość wytwarzanego gazu jest obliczana.
Przykłady obliczeń
Ćwiczenie 1
Gaz ma gęstość 0,0847 g/l do 17 ° C i ciśnienie 760 Torr. Jaka jest twoja masa trzonowa? Co to jest gaz?
Zaczynamy od równania
M = drt/p
Najpierw przekształcamy jednostki temperaturowe na Kelvin:
T = 17 ° C + 273,15 k = 290,15 K
A ciśnienie 760 Torr odpowiada ciśnieniu 1 atm. Teraz musisz tylko zastąpić wartości i rozwiązać:
M = (0,0847 g/l) (0,08206 L · atm · k-1· Mol-1) (290,15 K) / 1 atm
M = 2 016 g/mol
Ta masa trzonowa może odpowiadać pojedynczej gatunku: cząsteczka wodoru dwuatomowego, H2.
Ćwiczenie 2
Masa 0,00553 g rtęci (Hg) w fazie gazowej ma objętość 520 l i w temperaturze 507 K. Oblicz ciśnienie wywierane przez HG. Masa molowa HG wynosi 200,59 g/mol.
Problem jest rozwiązany za pomocą równania:
PV = NRT
Informacje o liczbie moli HG nie pojawiają się; Ale można je uzyskać za pomocą maski molowej:
Mole Hg = (0,00553 g Hg) (1 mol Hg/200,59 g)
Może ci służyć: tlen: właściwości, struktura, ryzyko, użycia= 2 757 · 10-5 Mole
Teraz musimy tylko wyczyścić P i zastąpić wartości:
P = nrt/v
= (2757 · 10-5 mole) (8 206 · 10-2 L · atm · k-1· Mol-1) (507 K)/ 520 l
= 2,2 · 10-6 bankomat
Ćwiczenie 3
Oblicz ciśnienie wytwarzane przez kwas solny wytwarzany przez reakcję 4,8 g gazu chloru (Cl2) z gazem wodorowym (h2), W objętości 5,25 l i w temperaturze 310 K. Masa molowa CL2 to 70,9 g/mol.
H2 g) + Cl2 g) → 2 HCl(G)
Problem jest rozwiązany za pomocą równania gazów idealnych. Ale ilość HCl jest wyrażana w gramach, a nie w molach, więc dokonuje się należytej transformacji.
Mole HCl = (4,8 g Cl2) (1 mol Cl2/70,9 g Cl2) (2 mol Hcl/1mol Cl2)
= 0,135 moli HCl
Zastosowanie równania prawa gazów idealnych:
PV = NRT
P = nrt/v
= (0,135 moli HCl) (0,08206 L · ATM · K-1· Mol-1) (310 k) / 5.25 l
= 0,65 atm
Ćwiczenie 4
Próbka 0,130 g związka gazowego zajmuje objętość 140 ml w temperaturze 70 ° C i pod ciśnieniem 720 Torror. Jaka jest twoja masa trzonowa?
Aby zastosować idealne równanie GASE, najpierw należy wprowadzić kilka zmian:
V = (140 ml) (1 l/1000 ml)
= 0,14 l
Mając objętość w litrach, teraz musisz wyrazić temperaturę w Kelvin:
T = 70 ° C + 273,15 k = 243,15 K
I wreszcie musimy przekształcić presję w jednostki atmosfery:
P = (720 Torr) (1 atm/760 Torr)
= 0,947 atm
Pierwszym krokiem w rozwiązaniu problemu jest uzyskanie liczby moli ze związku. W tym celu stosuje się równanie gazów idealnych i oczyszczaliśmy N:
PV = NRT
N = PV / RT
= (0,947 atm) (0,14 l) / (0,08206 l · atm · k-1· Mol-1) (243,15 K)
= 0,067 moli
Konieczne jest jedynie obliczenie ciasta trzonowego poprzez podzielenie gramów między uzyskane mole:
Masa molowa = gramy związku / liczba moli.
= 0,130 g / 0,067 moli
= 19,49 g/mol
Bibliografia
- Whitten, Davis, Peck i Stanley. (2008). Chemia. (8 wyd.). Cengage Learning.
- Iran. Levine. (2014). Zasady fizykochemii. Szósta edycja. MC Graw Hill.
- Glasstone. (1970). Traktat chemii fizycznej. Druga edycja. Aguilar.
- Mathews, c. K., Van Holde, K. I., I ahern, k. G. (2002). Biochemia. 3był Wydanie. Pearson Addison Wesley Editorial.
- Wikipedia. (2019). Gaz doskonały. Źródło: w:.Wikipedia.org
- Zespół redakcyjny. (2018). Boyle Law lub Boyle-Maleotte Law | Prawa gazowe. Odzyskane z: iquimicas.com
- Jessie a. Klucz. (S.F.). Idealne prawo gazowe i poddziały podrzędne. Źródło: openTextBC.AC
- « Arabia Saudyjska tradycje kultury, zwyczaje, gastronomia
- Produktywny obwód głównych stadiów mięsnych »

